Suy thận mạn là bệnh rất hay gặp ở khoa nội thận tiết niệu. Do đó việc tiếp cận bệnh nhân suy thận mạn là điều rất cần thiết trên lâm sàng.
Trong bài này, tôi sẽ trình bày về bệnh suy thận mạn từ A-Z, hi vọng bài viết này sẽ cung cấp cho bạn một lượng kiến thức để có thể thực hành lâm sàng hiệu quả.

Đầu tiên, bạn nên xem video này để có kiến thức tổng quan:
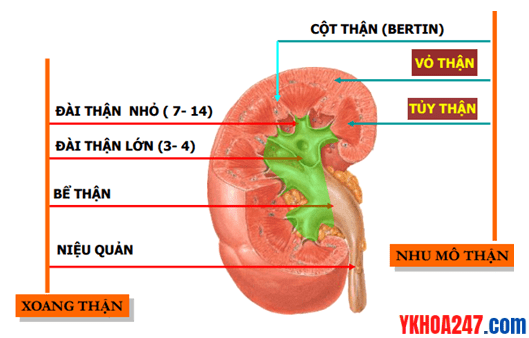
Giải phẫu thận
Đại thể
Mỗi người có 2 thận nằm phía sau phúc mạc, ở 2 bên cột sống.
Thận bên phải thấp hơn thận bên trái do có gan đè lên.

Cực trên thận ngang mức đốt sống D11 (bên trái ngang bờ trên D11, bên phải ngang bờ dưới D11). Cực dưới thận ngang mức mỏm ngang cột sống L3 (bên trái ngang bờ trên mỏm ngang L3, bên phải ngang bờ dưới mỏm ngang L3).
Mỗi thận có trọng lượng trung bình 130 – 135 gram, kích thước trung bình 12 x 6 x 3cm.

Nhìn từ phía sau: Thận là cơ quan sau phúc mạc nằm ở hai bên của cột sống từ T12-L3. Lưu ý rằng thận phải nằm sau một chút so với thận trái vì kích thước của gan lớn hơn so với lá lách.
Phía sau xương sườn 12 bắt chéo ngang qua thận, chia thận làm 2 phần: tầng ngực liên quan với phổi và khoang màng phổi; tầng bụng liên quan với thành lưng. Do thận nằm một nửa tầng bụng, một nửa tầng ngực nên bình thường khi khám thận chỉ sờ thấy cực dưới thận. Khi thận lớn thì khám phát hiện thận dễ dàng hơn.
Thận là một tạng đặc, có nhu mô dày 1,5 – 1,8cm, bao phủ ngoài nhu mô thận là bao thận dai và chắc.
Việc nắm rõ kích thước thận trên phương diện giải phẫu sẽ giúp bạn dễ dàng phát hiện được sự thay đổi kích thước thận khi đọc X quang và siêu âm => Thận lớn hay thận teo. Trong CKD thì thận teo, ngoại trừ trường hợp thận đa nang thì thận thường to hơn bình thường.
Ngoài việc nắm được kích thước thận thì việc đối chiếu bóng thận lên CSTL giúp bạn đánh giá được sự thay đổi kích thước nhanh hơn trên phim X-quang. Bình thường thì thận tương ứng với 3 – 4 đốt sống thắt lưng.
Nhu mô thận
Nhu mô thận được chia 2 vùng:
Vùng tủy chứa các tháp Malpyghi, mỗi tháp malpyghi tương ứng một đài nhỏ, có đỉnh hướng về đài nhỏ. Trong đó chứa hệ thống ống góp trước khi đổ vào đài thận.
Vùng vỏ thận là nơi chứa các đơn vị chức năng thận (nephron). Mỗi thận chứa 1 – 1,5 triệu nephron, tập trung chủ yếu ở vùng vỏ, chỉ 10 – 20% số nephron nằm vùng tủy thận.
Cấu trúc nhu mô thận
Rốn thận là nơi cuống thận đi vào thận.
Sinh lý thận
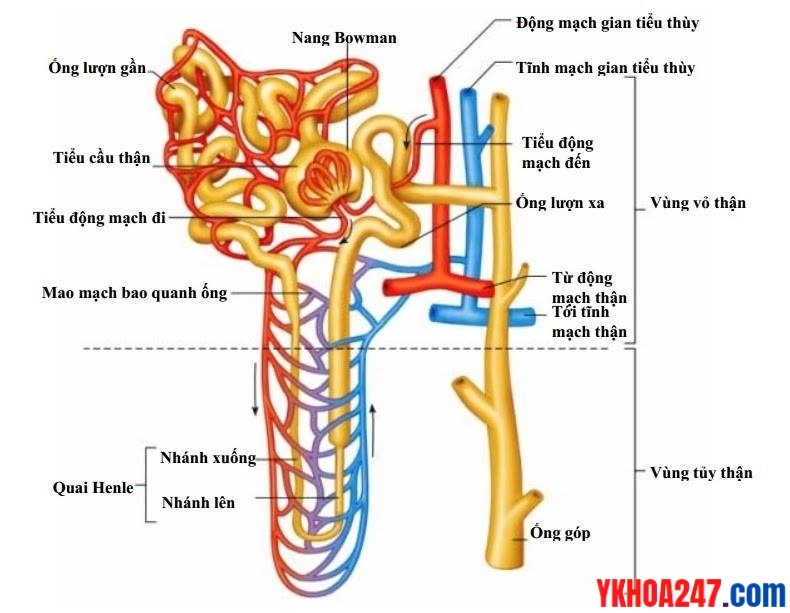
Cấu trúc và phân bố nephron ở thận
Thận có 2 chức năng quan trọng: chức năng tạo nước tiểu và chức năng nội tiết.
Chức năng tạo nước tiểu là chức năng chính của thận. Qua quá trình tạo nước tiểu, thận thực hiện các chức năng hết sức quan trọng để giữ sự hằng định nội môi:
– Điều hòa cân bằng nước và điện giải.
– Điều hòa cân bằng acid – base.
– Điều hòa áp suất thẩm thấu và thể tích dịch ngoại bào.
– Bài xuất các sản phẩm chuyển hóa và các hóa chất lạ ra khỏi cơ thể.
Chức năng nội tiết: thận bài tiết ra các hormon:
– Renin: tham gia điều hòa huyết áp.
– Erythropoietin: kích thích tủy xương sản sinh hồng cầu.
– Calcitriol (vitamin D): tham gia điều hòa chuyển hóa calci và phosphat trong cơ thể.
Việc nắm chắc về sinh lý thận sẽ giúp bạn dễ dàng giải thích được các triệu chứng lâm sàng và những thay đổi trên cận lâm sàng của suy thận mạn.
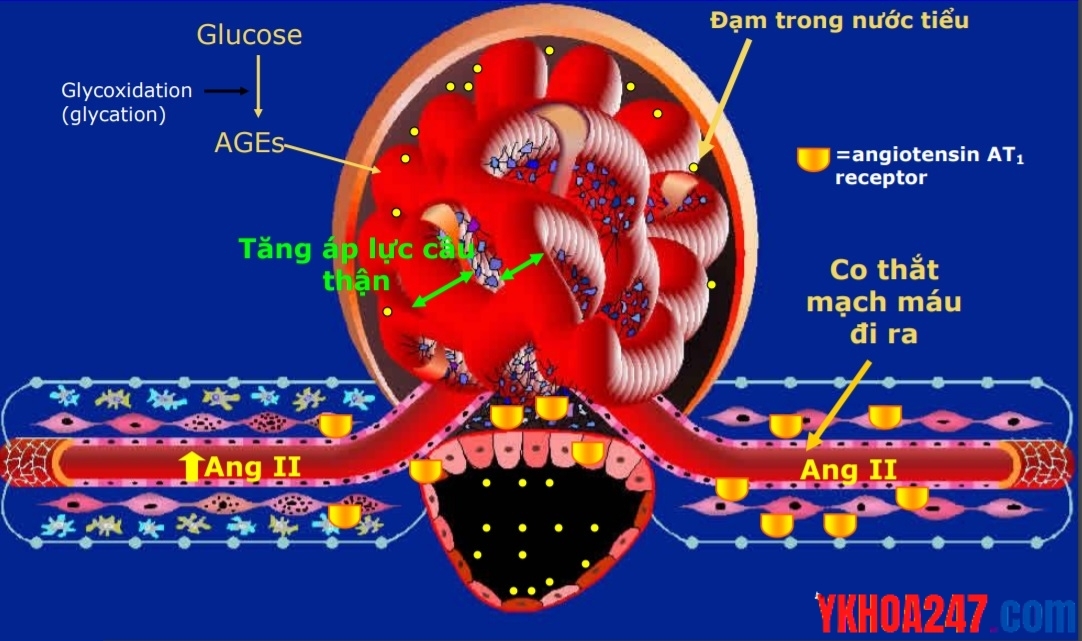
Hệ Renin – Angiotensin – Aldosteron
Khi huyết áp giảm, máu đến thận cũng giảm, làm các tế bào của tổ chức cận cầu thận bài tiết Renin vào trong máu. Dưới tác dụng của Renin, một phân tử protein của huyết tương là Angiotensinogen chuyển thành Angiotensin I.
Sau khi hình thành, dưới tác dụng của converting (còn gọi là enzyme chuyển có trong mao mạch phổi) Angiotensin I được chuyển thành Angiotensin II, đồng thời enzym chuyển lại phá hủy tác Bradykinin (là chất gây giãn mạch rất mạnh) .
Cơ chế gây tăng huyết áp của Angiotensin II:
1. Co tiểu động mạch sát với mao mạch. (Tác dụng co mạch của Angiotensin II mạnh gấp 30 lần so với Noradrenalin)
2. Kích thích lớp cầu của tuyến vỏ thượng thận bài tiết Aldosteron để tăng tái hấp thu ion Natri.
3. Kích thích trực tiếp ống thận làm tăng tái hấp thu Natri.
4. Kích thích vùng Postrema ở nền não thất IV làm tăng trương lực mạch máu.
5. Kích thích các cúc tận cùng thần kinh giao cảm tăng bài tiết Noradrenalin.
6. Làm giảm tái nhập Noradrenalin tái nhập lại các cúc tận cùng.
7. Làm tăng tính nhạy cảm của Noradrenalin đối với mạch máu.
Tất cả các tác dụng trên dẫn đến kết quả làm tăng huyết áp rất mạnh do làm tăng lưu lượng máu và tăng sức cản ngoại vi (Huyết áp = Cung lượng tim*Sức cản ngoại vi, Cung lượng tim = thể tích tâm thu*tần số tim).
Vai trò của hormone ADH (Vasopressin hay còn gọi là hormone kháng bài niệu)
(ADH = Anti Diurêtic Hormon: Anti=chống, Diurêtic = lợi tiểu)
Nguồn gốc: ADH là hormone của vùng dưới đồi, dự trữ ở thùy sau tuyến yên.
Tác dụng: co mạch trực tiếp + tăng tái hấp thu nước = tăng huyết áp
(ADH chỉ phát huy tác dụng khi huyết áp tâm thu giảm dưới 50 mmHg)

Hệ Renin – Angiotensin – Aldosteron
Tổng quan về bệnh thận mạn
Thận có chức năng lọc máu để bài tiết ra nước tiểu, các chất thải của cơ thể, điều chỉnh các chất điện giải, ngoài ra thận còn có chức năng duy trì sự ổn định của huyết áp và tham gia vào quá trình tạo máu. Vì một lý do nào đó làm suy giảm chức năng thận sẽ dẫn đến rối loạn các chức năng trên, kéo theo nhiều hệ lụy ảnh hưởng nhiều đến chất lượng cuộc sống thậm chí tử vong.
Bệnh thận mạn
Suy thận mạn là hậu quả cuối cùng của các bệnh thận – tiết niệu mạn tính làm chức năng thận suy giảm dần dần tương ứng với số lượng nephron của thận bị tổn thương và mất chức năng không hồi phục. Suy thận mạn làm giảm mức lọc cầu thận, rối loạn điện giải, tăng huyết áp, thiếu máu mạn tính.
Bệnh có thể tiến triển dần dần và nặng lên theo từng đợt và cuối cùng dẫn đến suy thận mạn giai đoạn cuối, lúc này 2 thận mất chức năng gần như hoàn toàn nên đòi hỏi phải điều trị thay thế thận như chạy thận nhân tạo, lọc màng bụng, ghép thận… tốn kém rất nhiều tiền của và gây mệt mỏi chán nản cho người bệnh.
Vì vậy suy thận mạn tính cần được chẩn đoán và điều trị kịp thời để cải thiện triệu chứng của bệnh đồng thời kéo dài thời gian chuyển thành suy thận giai đoạn cuối, kéo dài tuổi thọ người bệnh.
Định nghĩa
Nắm được các định nghĩa dưới đây cực kì quan trọng, thông qua những định nghĩa này bạn sẽ hiểu được bản chất của vấn đề. Các định nghĩa nghĩa này được tôi trình bày chủ yếu theo KDIGO 2012.
Bệnh thận mạn (chronic kidney disease) là những bất thường về cấu trúc hoặc chức năng thận, kéo dài trên 3 tháng và ảnh hưởng lên sức khỏe người bệnh.
Suy thận mạn được định nghĩa là một tình trạng suy giảm chức năng thận không hồi phục một cách từ từ, hàng tháng, hàng năm, thậm chí hàng chục năm do sự giảm dần về số lượng nephron chức năng. Suy thận mạn được xác định khi MLCT < 60ml/phút/1,73m2 da trên 3 tháng.
Suy thận mạn tương ứng với bệnh thận mạn giai đoạn 3 – 5.
Ở phần định nghĩa tôi muốn bạn phân biệt rạch ròi bệnh thận mạn với suy thận mạn.
Bệnh thận mạn được hiểu là những bệnh lý gây bất thường cấu trúc và chức năng của thận trên 3 tháng.
Còn suy thận mạn nhấn mạnh đến chức năng của thận bị suy giảm, được xác định khi MLCT < 60ml/phút/1,73m2 da.
Suy thận giai đoạn cuối (end stage renal disease, ESRD) là giai đoạn nặng nhất của suy thận mạn, biểu hiện lâm sàng do tình trạng tích tụ các độc chất, rối loạn nước và điện giải… Tình trạng này sẽ gây tử vong trừ phi bệnh nhân được điều trị với các biện pháp thay thế thận (thận nhân tạo, thẩm phân phúc mạc, ghép thận).
Suy thận mạn giai đoạn cuối tương ứng với suy thận mạn giai đoạn 5.
Hội chứng urê máu cao (urêmic syndrome) là một hội chứng lâm sàng và cận lâm sàng, phản ánh tình trạng rối loạn chức năng của tất cả các cơ quan khi chức năng thận bị suy giảm cấp hoặc mạn.
Hội chứng urê máu cao là một điểm nhấn quan trọng nhất trong việc khai thác triệu chứng lâm sàng khi bạn tiếp cận bệnh nhân suy thận mạn.
Hội chứng urê máu cao có phải là chỉ có nồng độ urê huyết thanh cao không?
Bạn phải nhớ, hội chứng urê máu cao “không đồng nghĩa” với chỉ có nồng độ urê huyết thanh tăng mà còn tăng cả những sản phẩm azote khác. Nên chính xác hơn, chúng ta nên sử dụng thuật ngữ “hội chứng tăng azote máu”.
Vậy tại sao trên lâm sàng chúng ta không sử dụng thuật ngữ “hội chứng tăng azote máu”?
Bởi vì không phải mọi sản phẩm azote đều định lượng được, nên việc theo dõi suy thận mạn bằng urê máu và creatinin huyết thanh đồng nghĩa với cách đơn giản nhất để theo dõi chức năng thận qua những xét nghiệm dễ dàng thực hiện được trên lâm sàng.
Tăng azote máu (azotemia) là sự gia tăng nồng độ các sản phẩm có nguồn gốc nitơ trong máu như protein, peptide, aminoacid, creatinin, urê, uric acid, ammoniac, hippurate, sản phẩm thoái hóa của acid nhân, polyamine, myoinositol, phenols, benzoate và indole.
Cơ chế bệnh sinh
Thuyết nephron nguyên vẹn
Tôi sẽ nói những điểm chính về thuyết này:
Khi số lượng nephron giảm đến một mức độ nào đó, các nephron còn lại không đủ đảm bảo chức năng thận, sẽ làm xuất hiện các triệu chứng của suy thận mạn. Số lượng nephron còn chức năng tiếp tục giảm dần do tiến triển của bệnh, làm mức lọc cầu thận giảm tương ứng cho tới suy thận giai đoạn cuối.
Thuyết nephron nguyên vẹn đã trở thành cơ sở lý luận về mặt sinh bệnh học của suy thận mạn.
Người ta thấy rằng, khi số lượng nephron chức năng giảm 75% thì mức lọc cầu thận giảm 50% so với mức bình thường, lúc này mới xuất hiện các triệu chứng của suy thận mạn.
Quá trình tiến triển của bệnh từ khi có bệnh thận mạn tính đến khi suy thận giai đoạn cuối trung bình là 10 năm, cũng có thể chỉ 5 năm hoặc 20 năm. Suy thận tiến triển nhanh hay chậm tùy thuộc vào nguyên nhân và các đợt tiến triển nặng của bệnh.
Có thể bạn chưa biết: Khi chúng ta sinh ra, mỗi bên thận có khoảng 1 triệu nephron, số lượng nephron này không thể tăng thêm mà chỉ có thể giảm đi khi chúng ta lớn lên.
Giả thuyết tăng lọc cầu thận (glomerular hyperfiltration)
Khi nephron bị mất, những nephron còn lại hoạt động bù trừ gây tăng lọc cầu thận, tăng tổn thương màng đáy cầu thận, kích hoạt phản ứng viêm tự phát, diễn tiến đến xơ hóa thận.
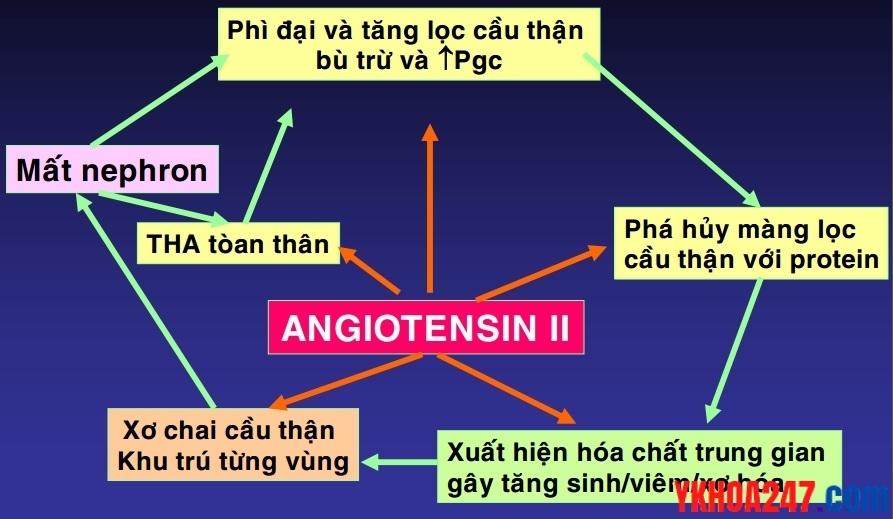
Giả thuyết tăng lọc cầu thận (glomerular hyperfiltration) của Brenner
Cơ chế bệnh sinh microalbumine niệu
Hiểu được cơ chế bệnh sinh của microalbumine niệu sẽ giúp bạn hiểu sâu về điều trị những bệnh nhân BTM có albumin niệu.
Albumine lọc qua màng đáy cầu thận tùy thuộc:
– Sự thay đổi tính thấm màng đáy: thay đổi tính chọn lọc của màng đáy về điện tích, về kích thước và hình dạng.
– Thay đổi huyết động học, tăng lọc cầu thận:
+ Tăng lưu lượng huyết tương qua cầu thận
+ Tăng áp lực lọc qua cầu thận
Cơ chế tổn thương cầu thận và tiểu albumine
Microalbumine niệu là dấu hiệu của tổn thương màng lọc cầu thận.
Nguyên nhân
Chúng ta đã biết, có rất nhiều nhóm nguyên nhân gây suy thận mạn. Tôi sẽ tập trung giải thích tại sao nguyên nhân đó lại có thể gây suy thận mạn nhằm giúp bạn hiểu rõ hơn bản chất của vấn đề.
Các bệnh lý ở cầu thận: chiếm 40% bệnh lý gây suy thận mạn bao gồm: viêm cầu thận cấp, hội chứng thận hư, viêm cầu thận mạn, viêm cầu thận do các bệnh hệ thống,…
Bệnh ống kẽ thận mạn do nguyên nhân nhiễm khuẩn hoặc không nhiễm khuẩn.
Bệnh đái tháo đường và tăng huyết áp là hai nguyên nhân làm tổn thương thận gây suy thận mạn tính hàng đầu ở các nước phát triển. Đái tháo đường typ 2 chiếm đến 30 – 50% nguyên nhân, trong khi tăng huyết áp chiếm hơn 27%.
Ngoài ra còn có một số nguyên nhân khác:
– Bệnh thận bẩm sinh và di truyền (thận đa nang, loạn sản thận, hội chứng Alport).
– Bệnh tự miễn (như lupus ban đỏ hệ thống, xơ cứng bì).
– Nhiễm độc trong thời gian kéo dài.
– Một số loại thuốc sử dụng để chữa trị các rối loạn bệnh lý cũng có thể làm tổn thương thận, dẫn đến suy thận mạn.
Bất kì trường hợp nào làm giảm lượng máu tới thận, làm tắc nghẽn nước tiểu mà gây tổn thương thực thể tại thận hoặc những bệnh lý tại thận đều có thể là nguyên nhân gây suy thận mạn, ví dụ như: tắc mạch động mạch thận, u xơ tuyến tiền liệt, nhiễm trùng đường niệu…
Đây là bảng tóm tắt nguyên nhân gây bệnh thận mạn. Để ý là bất kì bệnh lý nào liên quan đến thận đều có thể gây bệnh thận mạn.

Tại sao các bệnh cầu thận mạn lại có thể gây suy thận mạn?
Bởi vì trong bệnh cầu thận mạn thì có quá trình tổn thương thực thể xảy ra ở các cầu thận của hai bên thận, bao gồm các tình trạng tăng sinh, phù nề, xuất tiết, hoại tử hyalin và xơ hóa một phần hoặc toàn bộ cầu thận. Bệnh tiến triển mạn tính từ từ qua nhiều tháng, nhiều năm dẫn đến giảm số lượng nephron và thay vào đó là tổ chức xơ => giảm chức năng lọc của cầu thận => dẫn đến suy thận mạn.
Để ý đây là nhóm nguyên nhân gây suy thận mạn hay gặp nhất, chiếm 40% nguyên nhân.
Tại sao lupus ban đỏ hệ thống lại có thể gây suy thận mạn?
Lupus là bệnh hệ thống ảnh hưởng rất nhiều cơ quan trong đó có thận. Việc có nhiều tự kháng thể trong máu có thể tạo thành phức hợp kháng nguyên kháng thể (phức hợp miễn dịch) lắng đọng ở cầu thận => gây viêm và xơ hóa cầu thận => suy thận mạn.
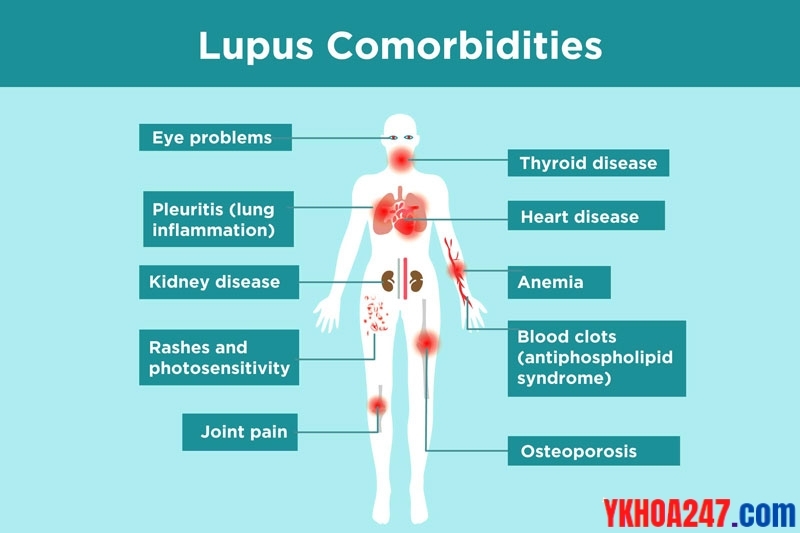
Tổn thương đa cơ quan trong bệnh lupus ban đỏ hệ thống, trong đó có thận.
Tại sao đái tháo đường lại có thể gây suy thận mạn?
Đái tháo đường nếu không được kiểm soát sẽ gây ra các biến chứng cấp và mạn đến các cơ quan như tim, mắt, thận, thần kinh, mạch máu… trong đó có biến chứng vi mạch thận hay còn gọi là bệnh thận đái tháo đường là nguyên nhân hàng đầu dẫn tới suy thận mạn tiến triển.
+ Do tổn thương động mạch thận: Đái tháo đường lâu ngày gây xơ vữa các mạch máu lớn, trong đó có động mạch thận, làm hẹp tắc mạch máu, hậu quả là gây tăng huyết áp và suy thận.
+ Do tổn thương các mạch máu nhỏ trong thận: Người bệnh đái tháo đường, huyết áp cao kéo dài sẽ làm tổn thương vi mạch ở thận => gây xơ hóa cầu thận => suy thận mạn [quan trọng nhất].
Đồng thời lượng đường trong máu cao, thận phải làm việc quá tải, nhiều ngày các lỗ lọc to ra gây rò rỉ albumin vi niệu ra ngoài nước tiểu, sau thời gian dài albumin niệu nhiều hơn và xuất hiện cả protein niệu.
+ Do tổn thương hệ thần kinh: Với người bệnh đái tháo đường việc truyền tín hiệu thần kinh từ bàng quang về não bị trục trặc, nên khi bàng quang bị căng giãn do nước tiểu nhưng não không nhận được tín hiệu truyền về. Do đó bệnh nhân không có cảm giác buồn tiểu hoặc muốn tiểu mà tiểu không được, dẫn đến ứ đọng nước tiểu lâu ngày gây nhiễm trùng đường tiết niệu, vi khuẩn đi ngược lên thận làm tổn thương thận và dẫn tới suy thận.
Tại sao tăng huyết áp lại có thể dẫn đến suy thận mạn?
Câu trả lời đã có trong bài tăng huyết áp. Bạn có thể xem tại đây.
Bạn phải biết là tăng huyết áp dẫn đến rất nhiều biến chứng khác nhau, đặc biệt đến tim, mắt, thận, não… thông qua cơ chế làm rối loạn chức năng mạch máu và mô học… Bên cạnh đó, các yếu tố nguy cơ của tăng huyết áp như đái tháo đường, tăng lipid máu, hút thuốc lá, chế độ ăn, ít vận động làm cộng hưởng và gây trầm trọng thêm các biến chứng của tăng huyết áp.
Tại sao Gout có thể gây suy thận mạn?
Trong bệnh Gout, có sự gia tăng nồng độ acid uric máu, dẫn đến lắng động tinh thể natri urat ở nhu mô thận, đài bể thận gây viêm, làm tổn thương nhu mô thận dẫn đến suy thận mạn. Tuy nhiên, suy thận mạn cũng có thể gây Gout.
Tại sao suy thận mạn lại có thể gây Gout?
Bởi vì acid uric được đào thải qua thận. Trong suy thận mạn, bệnh nhân có tình trạng giảm đào thải acid uric dẫn đến nồng độ acid uric trong máu tăng cao gây lắng động các tinh thể natri urat ở khớp dẫn đến Gout.
Gout có thể là nguyên nhân gây suy thận mạn, suy thận mạn cũng có thể là nguyên nhân gây Gout, nên đây được coi là vòng xoắn bệnh lý.
Trên lâm sàng, có rất nhiều bệnh nhân Gout trên nền suy thận mạn. Việc chẩn đoán suy thận mạn gây gout hay gout gây suy thận mạn đôi khi đặt ra.
Viêm cầu thận cấp sau nhiễm liên cầu có thể gây suy thận mạn không?
Câu trả lời là có thể. Tuy nhiên, VCTC sau nhiễm liên cầu thường gây tổn thương thận cấp và khỏi hoàn toàn. Nhưng một tỉ lệ nhỏ bệnh nhân (khoảng 5%) sau khi mắc VCTC sau nhiễm liên cầu cũng dẫn đến suy thận mạn.
Tại sao bệnh lý ống kẽ thận lại có thể dẫn đến suy thận mạn?
Bệnh lý ống kẽ thận gây xơ hóa mô kẽ thận, teo ống thận và hoại tử nhú thận, làm mất dần chức năng thận dẫn đến suy thận mạn.
Tại sao hẹp động mạch thận lại có thể gây suy thận mạn?
Hẹp động mạch thận sẽ làm giảm lượng máu đến thận lâu ngày sẽ tổn thương các nephron => giảm mức lọc cầu thận => suy thận mạn.
Tại sao hẹp động mạch thận lại có thể gây tăng huyết áp?
Phân chia ra 2 trường hợp để trả lời:
Hẹp động mạch thận một bên và thận bên đối diện bình thường:
+ Khi mức độ hẹp động mạch thận không nhiều, sự giảm áp lực tưới máu thận là vừa phải và hoạt động thích hợp của hệ thống renin – angiotensin sẽ điều chỉnh những rối loạn huyết động học tại thận, do vậy có thể không có triệu chứng lâm sàng.
+ Khi động mạch thận hẹp ở mức độ nhiều, sự bù trừ trong thận sẽ không đủ để bình thường hoá được huyết động tại thận, do vậy tưới máu thận sẽ giảm và kích thích hệ thống renin – angiotensin thường xuyên làm gia tăng angiotensin II dẫn đến co thắt các tiểu động mạch chung và gây tăng huyết áp. Ngoài ra, còn có cơ chế của tăng aldosterol thứ phát và tăng giải phóng cũng như tăng tác dụng của noradrenalin thứ phát sau hoạt hoá hệ thống renin – angiotensin.
Lưu ý: Tăng huyết áp chỉ xuất hiện khi hẹp ở mức độ nhiều, làm giảm khẩu kính động mạch thận từ 70 đến 80%.
+ Ở thận đối diện không có hẹp động mạch, sẽ có sự gia tăng áp lực trong thận đưa đến tăng bài tiết natri của thận này (gọi là natri niệu do tăng áp lực) nhưng sự tiết renin của thận này thì giảm nhiều.
+ Ở thận bị hẹp động mạch, có tăng tiết renin, giảm bài tiết natri, tăng lượng Angiotensin II trong thận làm co thắt các tiểu động mạch đi ở cầu thận (cơ chế tự điều hoà) góp phần vào giữ độ lọc cầu thận của thận hẹp.
+ Khi hẹp động mạch thận đã lâu thì việc phẫu thuật có thể không còn làm giảm huyết áp được nữa, do có những thương tổn ở các tiểu động mạch thứ phát sau tăng huyết áp ở những nơi không hẹp động mạch.
Hẹp động mạch hai bên hoặc hẹp động mạch thận trên thận độc nhất:
Trong tình huống này sự giảm tưới máu động mạch liên quan đến tất cả thương tổn ở thận. Ở đây không có thận đối diện bình thường để giới hạn tăng huyết áp và gia tăng thể tích. Vì tăng thể tích máu làm giảm tiết renin, nên tăng huyết áp phụ thuộc một phần vào sự gia tăng thể tích máu đến thận.
Tại sao hẹp động mạch thận 2 bên thì không điều trị ACEI?
Ở những bệnh nhân bị tăng huyết áp do hẹp động mạch thận, việc hạ huyết áp bằng thuốc ức chế men chuyển, do tổn thương hẹp lòng mạch thận nên sẽ có xu hướng làm giảm áp lực lọc cầu thận dưới mức bình thường.
Mặc dù GFR có thể được duy trì bằng cách tự điều hòa, nhưng việc ngăn chặn sự tạo thành angiotensin II bằng thuốc ức chế men chuyển sẽ làm giảm phản ứng này => làm giảm GFR => Suy thận cấp tính.
Hai nguyên nhân chính gây hẹp động mạch thận là gì?
Xơ vữa động mạch thận
Xơ vữa động mạch là sự tích tụ chất béo, cholesterol và các chất khác (mảng bám) trong và trên thành động mạch của người bệnh.
Khi sự tích tụ ngày càng lớn, làm động mạch thận giảm đàn hồi và hẹp lại, dẫn đến giảm lưu lượng máu tới thận.
Hầu hết các trường hợp hẹp động mạch thận xảy ra do xơ vữa động mạch.

Xơ vữa động mạch thận
Loạn sản cơ
Trong chứng loạn sản cơ, cơ trong thành động mạch phát triển bất thường dẫn đến hẹp động mạch thận. Tình trạng này phổ biến hơn ở phụ nữ và có thể là bẩm sinh.
Xơ vữa động mạch và loạn sản xơ cơ cũng có thể ảnh hưởng đến các động mạch khác trong cơ thể và gây ra các biến chứng khác.
Đặc điểm THA trong bệnh hẹp ĐMT?
+ Thường bắt đầu tăng huyết áp ở độ tuổi dưới 30 tuổi hoặc trên 55 tuổi với tăng huyết áp nặng.
+ Xuất hiện tăng huyết áp đột ngột hoặc tăng huyết áp nặng lên dù được điều trị tốt.
+ Có thể phát hiện một tiếng thổi tâm thu ở vùng thượng vị hoặc ở cạnh rốn. Bạn có thể nghe được tiếng thổi liên tục trong một số trường hợp.
+ Phát hiện có sự suy giảm chức năng thận hoặc bất thường nước tiểu (protein niệu, đái máu vi thể) trước điều trị tăng huyết áp.
+ Không có hiệu quả khi điều trị bằng thuốc chẹn bêta, lợi tiểu, dãn mạch (hydralazine) và ức chế calci.
+ Suy giảm chức năng thận khi dùng thuốc ức chế men chuyển.
Cần biết rằng, triệu chứng lâm sàng chỉ giúp gợi ý hẹp ĐMT, cận lâm sàng giúp chẩn đoán hẹp.
Làm sao để chẩn đoán hẹp động mạch thận?
Việc chẩn đoán xác định hẹp động mạch thận hầu như vẫn dựa hoàn toàn vào các thăm dò hình ảnh, trong đó chụp động mạch thận vẫn giữ một vai trò quyết định. Lâm sàng chỉ mang tính gợi ý và xét nghiệm không xâm nhập được ưa chuộng nhất cho đến nay là siêu âm Doppler động mạch thận.
Triệu chứng lâm sàng
Bạn biết đấy, suy thận mạn diễn tiến âm thầm từ không có triệu chứng rồi bỗng nhiên rầm rộ bởi các triệu chứng của hội chứng tăng urê máu.
Ở đây, tôi sẽ trình bày triệu chứng theo hội chứng để sát với thực tế lâm sàng.
Thứ nhất, nổi trội nhất để hướng đến chẩn đoán STM đó là hội chứng tăng urê máu. Tăng urê máu được cho là nguyên nhân chủ yếu gây nên các triệu chứng của STM.
Bệnh nhân suy thận mạn hay vào viện vì lý do gì?
Lý do chủ yếu để vào viện của bệnh nhân STM đó là các triệu chứng của hội chứng tăng urê máu, mà nhiều nhất là triệu chứng mệt mỏi, nôn, buồn nôn, chán ăn…
Hoặc một vài bệnh nhân tái khám, thấy kết quả creatinine máu rất cao => đề nghị nhập viện.
Vẻ mặt của bệnh nhân suy thận mạn?
Bệnh nhân STM thường có vẻ mặt xanh xao thiếu máu, xơ xác, thể trạng mệt mỏi… => Nếu bạn tinh ý, thì đây là một đặc điểm rất dễ nhận biết khi quan sát, nhất là ở những bệnh nhân BTM giai đoạn cuối, với mức urê máu cao.
Hội chứng tăng urê máu

Sự biểu hiện lâm sàng của hội chứng này trên lâm sàng rất đa dạng vì sự tăng urê máu ảnh hưởng lên nhiều hệ cơ quan khác nhau.
Hệ tim mạch
Sự thay đổi bất thường của nồng độ urê máu có thể làm tăng huyết áp, khiến mạch đập nhanh, nhỏ. Đặc biệt có thể gây ra trụy mạch, nguy hiểm đến tính mạng đặc biệt đối với người bị suy thận giai đoạn cuối. Bệnh nhân cũng có thể bị phù phổi cấp và viêm màng ngoài tim…
Tại sao các biểu hiện tim mạch trong hội chứng tăng urê máu lại nghiêm trọng?
Vì đây là những biểu hiện nguy hiểm nhất, dễ làm bệnh nhân tử vong nhất. Thông thường, những biểu hiện tim mạch thường xảy ra trên bệnh nhân STM giai đoạn cuối, nhưng nếu những triệu chứng này xảy ra sớm thì bệnh nhân có thể tử vong trước khi điều trị thay thế thận. Do đó chúng ta cần quan tâm, phòng ngừa biến chứng này.
Trên lâm sàng, khi bạn phát hiện được tiếng cọ màng ngoài tim ở bệnh nhân suy thận mạn thì đó là một dấu hiệu cảnh báo nguy hiểm, bệnh nhân thường tử vong sau đó nếu không được lọc máu kịp thời.
Tại sao suy thận mạn lại có thể gây phù phổi cấp?
Bạn nên biết rằng phù phổi cấp ở đây có thể là do tăng tính thấm màng phế nang – mao mạch trong hội chứng urê máu cao, nhưng chủ yếu là do suy tim sung huyết gây ứ dịch tại phổi.
Vì sao bệnh nhân suy thận mạn có thể bị viêm màng ngoài tim?
Bởi vì trong suy thận mạn gây tăng urê máu. Độc tính của urê máu lên màng ngoài tim => tăng tiết dịch thông qua phản ứng viêm => tràn dịch màng ngoài tim.
Tuy nhiên, tôi cũng muốn khẳng định lại: Viêm màng ngoài tim trong suy thận mạn bạn sẽ ít gặp trên lâm sàng. Nếu gặp thì bệnh nhân đang ở tình trạng nặng và có thể nằm ở ICU rồi.
Hệ tiêu hóa
Ở mức độ nhẹ, bệnh nhân thường cảm thấy chướng bụng, đầy hơi, ăn không ngon. Khi ở mức độ nặng hơn có thể gây buồn nôn, tiêu chảy, viêm loét niêm mạc miệng và họng, có dấu hiệu đen lưỡi. Trường hợp urê máu tăng quá cao người bệnh có thể bị xuất huyết tiêu hóa.
Tại sao người bệnh suy thận mạn lại có thể có biểu hiện nôn, buồn nôn, xuất huyết tiêu hóa?
Bởi vì khi thận suy, urê và các sản phẩm azote tích tụ trong máu và được tăng thải ra đường tiêu hóa, sau đó được vi khuẩn đường ruột phân hủy thành amoniac.
Amoniac sẽ tạo hơi thở có mùi khai và có vị kim loại trong miệng, gây viêm loét đường tiêu hóa gây ra đau bụng, buồn nôn, nôn và xuất huyết tiêu hóa, gây chán ăn (bắt đầu khi mức lọc cầu thận giảm còn 50-60 ml/phút/1,73 m2), nấc cục, buồn nôn và nôn do hội chứng urê máu cao.
Người bệnh phải đảm bảo chế độ ăn như thế nào để hạn chế các triệu chứng trên?
Người bệnh nên tiết chế giảm đạm nhập sẽ giúp giảm các triệu chứng trên, tuy nhiên sẽ tăng nguy cơ suy dinh dưỡng.
Hệ hô hấp
Người bệnh thường xuyên bị rối loạn nhịp thở, hơi thở yếu, chậm và có mùi NH3 (amoniac).
Hệ thần kinh
Người bệnh có thể đau đầu, hoa mắt, chóng mặt ở mức độ nhẹ; nặng hơn thì rơi vào trạng thái mơ màng, nói mê, vật vã. Khi urê máu tăng cao ở mức độ nặng nhất có thể dẫn đến co giật, đồng tử co lại, hôn mê và phản ứng kém với ánh sáng.
Cơ chế nào đã làm bệnh nhân có các triệu chứng hệ thần kinh ở trên?
Bởi vì suy thận mạn sẽ gây tích tụ các sản phẩm chuyển hóa của nitrogen (guanidine, methylguanidine, guanidinosuccinic acid…), các chất có trọng lượng phân tử kích thước trung bình, như hormon tuyến cận giáp.
Chính các chất trên tác động lên hệ TKTW, thần kinh ngoại biên và thần kinh thực vật. Tùy theo mức độ tăng azote máu nặng hay nhẹ và giai đoạn suy thận mạn mà triệu chứng có thể nhẹ nhàng hoặc nặng.
Lưu ý: Các giải thích cuối cùng cũng nói đến độc tính của các sản phẩm azote máu lên cơ thể.
Hệ huyết học
Tùy thuộc vào từng giai đoạn mà mức độ ảnh hướng có thể khác nhau, thường tăng urê máu sẽ dẫn đến tình trạng thiếu máu và xuất huyết.
Vì sao tăng urê máu lại có thể gây xuất huyết?
Bởi vì đặc tính của nitơ là rất dễ thấm qua thành mạch, khi nitơ thoát ra ngoài mạch máu và các tổ chức, kéo theo cả hồng cầu, huyết tương cùng ra. Cho nên khi urê máu tăng dễ gây xuất huyết.
Ngoài độc tính urê, còn có yếu tố nào khiến bệnh nhân dễ xuất huyết nữa không?
Trong suy thận mạn, người ta thường thấy nhóm đối tượng này có sự rối loạn chức năng đông máu. Cụ thể là nhóm đối tượng này thường bị giảm tỉ prothrombin, giảm độ tập trung tiểu cầu, giảm yếu tố III tiểu cầu… => dễ xuất huyết theo các mức độ khác nhau.
Trường hợp nào mà suy thận mạn mà máu dễ tăng đông?
Nếu bệnh nhân của bạn bị bệnh thận mạn do hội chứng thận hư thì có biểu hiện tăng đông, do mất albumin và các yếu tố chống đông máu.
Vị trí nào thường hay bị xuất huyết?
Thường gặp ở các vị trí, da, niêm mạc… Còn xuất huyết tiêu hóa và xuất huyết não ít gặp hơn nhưng đây là những thể nặng nhất.
Trên lâm sàng, khi gặp những bệnh nhân suy thận mạn có những biểu hiện xuất huyết da, niêm mạc thì bạn nên thận trọng để ý các dấu hiệu xuất huyết não và xuất huyết tiêu hóa.
Thân nhiệt
Sự thay đổi urê trong máu khiến nhiệt độ cơ thể giảm.
Tuy nhiên, bạn nên nhớ các triệu chứng của hội chứng tăng ure máu là không đặc hiệu và đôi khi bị nhầm lẫn với nhiều bệnh cảnh lâm sàng khác nên bệnh nhân có thể vào rất nhiều khoa khác nhau. Tôi sẽ chỉ cho bạn cách đơn giản để phân biệt các triệu chứng do tăng urê hay bệnh cảnh khác, đó là khi nồng độ urê máu giảm thì các triệu chứng cũng giảm theo nếu đó là triệu chứng do tăng urê máu khi chúng ta điều trị đúng.
Hội chứng thiếu máu đẳng sắc hồng cầu bình thường
Về chẩn đoán thiếu máu thì khá dễ, dựa trên công thức máu. Ở những bệnh nhân suy thận mạn, thường chỉ giảm số lượng hồng cầu. Trong khi đó, số lượng bạch cầu và tiểu cầu gần như bình thường.
Chú ý: thiếu máu là triệu chứng rất thường gặp trên một bệnh nhân suy thận mạn. Trên lâm sàng bạn dễ dàng nhận biết được các dấu hiệu thiếu máu: xanh xao, da nhợt nhạt… Nhờ công thức máu mà bạn chẩn đoán xác định.
Bệnh nhân suy thận mạn càng nặng thì tình trạng thiếu máu càng rõ, điều này phản ánh mức độ thiếu máu tương quan với mức độ nặng của bệnh suy thận mạn.
Dấu thiếu máu trong suy thận bạn cũng giúp bạn phân biệt với suy thận cấp.
Trên lâm sàng, nếu bạn nhận thấy mức độ thiếu máu của bệnh nhân nặng hơn, không phù hợp với mức độ suy thận thì bạn nên nghi ngờ và tìm kiếm thêm nguyên nhân gây thiếu máu khác trên bệnh nhân.
Tăng huyết áp
Tăng huyết áp rất hay gặp trong STM, việc kiểm soát tốt huyết áp sẽ giúp ngăn chặn các biến chứng THA lên các cơ quan đích khác. Tăng huyết áp trên thực hành lâm sàng bạn sẽ gặp rất rất nhiều. Bạn có thể tham khảo bài Tăng huyết áp để biết thêm.
Tại sao suy thận mạn gây tăng huyết áp?
Về nguyên nhân gây tăng huyết áp trên bệnh thận mạn có rất nhiều cơ chế, tuy nhiên tôi muốn nhấn mạnh 2 cơ chế chính:
(1) Thận suy => không đào thải được nước và chất điện giải => ứ dịch và điện giải gây tăng huyết áp.
(2) Suy thận mạn => kích hoạt hệ RAA => tiết renin => angiotensin II => tăng huyết áp.
Tăng huyết áp gây suy thận mạn hay suy thận mạn gây tăng huyết áp?
Đây là một câu hỏi khá thú vị. Chúng ta có thể phân biệt dựa vào:
+ Dựa vào tiền sử: thời gian xuất hiện THA và suy thận mạn. Trên lâm sàng rất khó để xác định được, nên bạn phải tham khảo sổ khám bệnh của bệnh nhân.
+ Nếu tăng huyết áp xuất hiện trước suy thận mạn thì thường kèm theo tổn thương cơ quan đích như mắt, tim, mạch máu.
+ Trong tăng huyết áp đơn thuần thì việc điều trị đáp ứng khá tốt, còn trong bệnh thận mạn thường rất khó kiểm soát được huyết áp về mức yêu cầu.
+ Có sự tương quan giữa mức độ THA và suy thận mạn. Nếu suy thận mạn có trước thì suy thận mạn thường ở giai đoạn cuối. Nếu THA có trước thường thì THA thường có phân độ nặng, còn suy thận mạn thường ở giai đoạn sớm.
Tuy nhiên trên lâm sàng có nhiều trường hợp không thể phân biệt được.
Nếu bệnh nhân bị suy thận mạn giai đoạn cuối thì việc xác định THA gây suy thận mạn không còn ý nghĩa nữa, vì chúng ta không thể giúp phục hồi chức năng thận cho bệnh nhân nữa.
Phù
Mang đặc điểm phù do bệnh thận: phù toàn, trắng, mềm, ấn lõm, nghỉ ngơi giảm phù.
Phù thường gặp ở những bệnh nhân bệnh lý cầu thận. Ngược lại, bệnh lý viêm thận bể thận thường không phù.
Tại sao suy thận mạn lại có thể gây phù?
Bởi vì thận suy => không đào thải được nước => ứ dịch => phù.
Tuy nhiên, phù trong suy thận mạn khó quan sát do bệnh nhân đã điều trị bằng lợi tiểu. Trong bệnh thận thì phù nặng nhất vẫn là hội chứng thận hư.
Phù nguy hiểm nhất trong suy thận mạn?
Đó là phù phổi cấp.
Đây là một biến chứng cấp tính.
Vì sao phù lại thường gặp ở những bệnh nhân suy thận mạn do các bệnh lý cầu thận hơn là do viêm thận bể thận?
Ở những bệnh lý cầu thận mạn, có sự tổn thương màng lọc cầu thận, dẫn đến protein máu thoát qua nước tiểu làm giảm áp lực keo dẫn đến phù. Ở bệnh lý viêm thận bể thận không có hiện tượng này.
Tiểu ít
Ở bệnh nhân suy thận mạn thì bệnh nhân thường có biểu hiện thiểu niệu, vô niệu ở giai đoạn cuối. Tuy nhiên, giai đoạn đầu bệnh nhân thường tiểu nhiều hơn bình thường (đa niệu).
Vì sao giai đoạn đầu của suy thận mạn bệnh nhân thường có biểu hiện đa niệu?
Có thể bạn chưa biết, các chức năng của thận bị suy giảm một cách không đồng bộ, trong đó chức năng cô đặc nước bị suy giảm đầu tiên, đó chính là nguyên nhân gây nên tình trạng đa niệu ở bệnh nhân suy thận mạn ở giai đoạn đầu.
Đa niệu cũng là một cơ chế bù trừ giúp bệnh nhân suy thận mạn có thể thải trừ một số lượng nào đó các chất cần đào thải. Theo Bricker, các nephron bị tổn thương nhiều sẽ không còn hoạt động, các nephron bình thường còn lại đảm nhiệm tất cả công việc bài tiết như khi thận còn bình thường. Vì áp lực bài tiết rất lớn nên các nephron này bị phì đại và vì khối lượng các chất hòa tan đưa đến đây rất nhiều gây nên tình trạng lợi niệu thẩm thấu.
Trên lâm sàng, biểu hiện đa niệu ở bệnh nhân suy thận mạn thường ít được chú trọng vì thời điểm suy thận mạn giai đoạn sớm bệnh nhân không vào viện. Rất nhiều bệnh nhân suy thận mạn trong lúc nằm viện, đa số có dùng lợi tiểu (lợi tiểu quai/thiazide) nên biểu hiện thiểu niệu, vô niệu không còn rõ nữa.
Tầm quan trọng của việc đi tiểu ở bệnh nhân suy thận mạn giai đoạn cuối
Bởi vì những bệnh nhân suy thận mạn giai đoạn cuối thường được điều trị thay thế thận với chạy thận nhân tạo. Không phải tất cả các chất thải được lọc qua màng lọc của thận nhân tạo nên việc đi tiểu có vai trò rất quan trọng để thải trừ các chất thải mà không thể lọc được.
Cho nên, ở bệnh nhân suy thận mạn giai đoạn cuối, việc điều trị bảo tồn lượng nước tiểu có ý nghĩa quan trọng trong việc kéo dài thời gian sống cho bệnh nhân.
Cận lâm sàng
Xét nghiệm quan trọng nhất trong suy thận mạn là gì?
Đánh giá mức lọc cầu thận thông qua Creatinine máu.
Creatinine máu thì máy đã cho kết quả. Việc của bạn chỉ là tính mức lọc cầu thận thông qua kết quả Creatinine.
Việc tính eGFR đơn giản bằng phần mềm trên điện thoại, bạn có thể tải về ( phiên bản Android hoặc phiên bản IOS ) để tính. Sau khi tính xong eGFR thì phân độ suy thận mạn.
Xét nghiệm máu
Xét nghiệm công thức máu thấy gì?
Đó chính là hội chứng thiếu máu đẳng sắc hồng cầu bình thường.
Số lượng hồng cầu giảm, nồng độ hemoglobin giảm, hematocrit giảm. Mức độ thiếu máu tỉ lệ với mức độ nặng của suy thận. Số lượng bạch cầu và tiểu cầu bình thường.

Công thức máu ở một bệnh nhân suy thận mạn
Tại sao suy thận mạn lại gây thiếu máu?
Suy thận mạn gây thiếu máu bởi vì:
(1) Giảm tiết erythropoietin (1 chất nội tiết có vai trò quan trọng trong quá trình tạo hồng cầu, 90% được tiết ở thận,10% ở gan).
(2) Đời sống hồng cầu giảm (do sống trong môi trường nhiều chất độc hại).
(3) Chảy máu và vỡ hồng cầu trong hội chứng tăng urê máu.
(4) Thiếu nguyên liệu tạo máu (protein, chất dinh dưỡng…).
(5) Mất máu do quá trình lọc máu.
(6) Nguyên nhân khác: kháng thể đề kháng, xơ hóa tủy, thuốc, do xét nghiệm…
Thiếu máu trong suy thận mạn chủ yếu là do giảm tiết erythropoietin.
Đặc điểm thiếu máu trên bệnh nhân suy thận mạn có gì đặc biệt?
Đặc điểm thiếu máu trên bệnh nhân suy thận là: thiếu máu đẳng sắc, hồng cầu bình thường, hồng cầu giảm không kèm với sự giảm của dòng bạch cầu và tiểu cầu (điểm khác so với thiếu máu trong xơ gan).
Xét nghiệm sinh hóa máu thấy gì?
Trong phần sinh hóa máu bạn nên chú trọng vào sự tăng urê và creatinin máu.

Nitơ phi protein trong máu tăng: người ta thấy có 2 nhóm, một nhóm nitơ phi protein trong máu tăng sớm, tăng sớm khi mức lọc cầu thận bắt đầu giảm, đại diện là urê và creatinin máu.
Nhóm khác, nitơ phi protein trong máu tăng muộn, chỉ tăng khi mức lọc cầu thận giảm xuống dưới 30 ml/phút/1,73m2 đại diện là acid uric.
Tăng urê máu còn liên quan đến chế độ ăn và mức độ dị hóa protein trong cơ thể. Ăn nhiều đạm, sốt, nhiễm khuẩn, chảy máu tiêu hóa, mất nước làm nồng độ urê máu tăng nhanh. Nồng độ creatinin máu ít phụ thuộc vào chế độ ăn, chủ yếu phụ thuộc vào khối lượng cơ của cơ thể nên phản ánh chính xác hơn mức độ suy thận.
Tại sao suy thận mạn lại làm tăng urê và creatinin?
Bởi vì trong suy thận mạn thì thận kém đào thải các nitơ phi protein, chúng là những sản phẩm thoái giáng cuối cùng của protein, trong đó có urê và creatinin. Vì vậy, khi suy thận mạn thì gây tăng urê và creatinin.

Một bệnh nhân suy thận mạn có mức urê và creatinin máu tăng rất cao.
Những điểm chính về urê máu
Urê có trọng lượng phân tử là 60,06, nồng độ urê máu bình thường là 2,5-6,7 mmol/l. Mỗi ngày thận đào thải 250-500 mmol/24 giờ, hệ số thanh thải urê bình thường là 60-84 ml/phút. Bình thường lượng urê chiếm 45-50% tổng lượng nitơ phi protein trong máu.
Khi suy thận, nồng độ urê trong máu tăng nhanh hơn các nitơ phi protein khác và urê có thể chiếm tới 80% tổng lượng nitơ phi protein trong máu. Khi urê máu tăng thì các nitơ phi protein khác trong máu cũng tăng.
Tại sao lại làm xét nghiệm urê máu?
Vì urê dễ định lượng. Khi urê máu tăng quá cao (trên 30 mmol/l), có thể gây nên một số triệu chứng lâm sàng (chính là hội chứng tăng urê máu) như chán ăn, buồn nôn, nôn, mệt mỏi, đau đầu, hạ thân nhiệt, loét niêm mạc miệng, loét niêm mạc đường tiêu hóa, viêm màng ngoài tim…
Có phải urê máu tăng thì bệnh nhân phải có các triệu chứng của hội chứng tăng urê máu không?
Câu trả lời là không. Bằng chứng là một số người có urê máu cao nhưng không có triệu chứng hoặc triệu chứng nhẹ. Bởi vì ngưỡng xuất hiện triệu chứng của mỗi người là khác nhau. Tuy nhiên, nếu urê máu tăng càng cao thì các triệu chứng càng nặng.
Hội chứng tăng urê máu lâm sàng gồm những gì?
Urê máu tăng ảnh hưởng đến rất nhiều cơ quan. Tôi đã nói ở phần triệu chứng của hội chứng tăng urê máu.
Những điểm chính về Creatinin máu
Creatinin có trọng lượng phân tử là 113,1 và nồng độ bình thường trong máu là 44-106 µmol/l.
Creatinin là sản phẩm thoái biến creatin của cơ.
Lượng creatin trong cơ chiếm 98% tổng lượng creatin của cơ thể (tổng lượng creatin trong cơ thể khoảng 100g), lượng creatin cung cấp từ thức ăn chỉ chiếm 600-800 mg/24giờ. Mỗi ngày có khoảng 1,6% lượng creatin từ cơ được chuyển hóa để tạo thành creatinin. Mỗi ngày thận đào thải 8-18 mmol creatinin/24 giờ.
Tại sao creatinin phản ánh chức năng thận chính xác hơn urê?
Bởi vì nồng độ urê máu bị ảnh hưởng bởi rất nhiều yếu tố: chế độ ăn nhiều đạm, xuất huyết tiêu hóa, nhiễm trùng…nên không phản ánh được chính xác chức năng thận.
Trong khi với creatinin, thì sự tăng nồng độ creatinin máu ít phụ thuộc vào nồng độ creatinin ngoại sinh và chỉ thải qua thận nên phản ánh mức độ suy thận chính xác hơn mức độ tăng urê máu.
Vì vậy, định lượng nồng độ creatinin trong máu được dùng để theo dõi và đánh giá chức năng thận.
Xét nghiệm albumin máu thấy gì?
Protein máu giảm, albumin máu giảm do mất protein qua nước tiểu kéo dài, do chế độ ăn giảm protein, do giảm tiêu hóa và hấp thu protein từ đường ruột.
Tuy nhiên, trên lâm sàng, không phải bệnh nhân nào cũng giảm albumin máu. Sự giảm albumin máu chỉ nổi trội ở những bệnh nhân STM do hội chứng thận hư.
Xét nghiệm biland lipid máu thấy gì?
Lipid máu tăng, tăng cả lipid toàn phần, cholesterol và triglycerid, đặc biệt khi có hội chứng thận hư.
Trên thực tế lipid máu không biến đổi nhiều ở bệnh nhân STM, nhưng sự biến đổi này phụ thuộc vào từng bệnh nhân cụ thể, có mắc bệnh kèm theo hay không? => Lipid máu không có giá trị nhiều!
Xét nghiệm điện giải đồ thấy gì?
Điện giải đồ là một xét nghiệm quan trọng ở bệnh nhân suy thận mạn. Kết quả thường là:
+ Kali máu tăng
+ Natri máu giảm
Tại sao Kali máu thường tăng?
Bởi vì trên bệnh nhân suy thận mạn thường có nhiều nhân gây tăng Kali, bao gồm:
– Thận suy làm giảm quá trình bài xuất kali.
– Giải phóng kali nội bào do vỡ tế bào hồng cầu (giảm đời sống hồng cầu và vỡ hồng cầu do urê máu tăng cao).
– Bệnh nhân suy thận hay có toan chuyển hóa làm quá trình điều hòa của cơ thể diễn ra như sau:
+ Điều hòa tại tế bào: tăng sự trao đổi ion kali và H+ (H+ đi vào tế bào và kali đi ra ngoài tế bào).
+ Tại thận khi có toan chuyển hóa thì cơ thể sẽ tăng bài xuất H+ đồng thời cố giữ K+ (2 ion có tính đối nghịch nhau).

Tăng Kali máu
Phân độ tăng Kali máu trên lâm sàng
Kali máu bình thường: 3,5 – 5 mmol/L
– Tăng Kali máu khi ≥ 5,5 mmol/L
– Theo Hướng dẫn của Hội đồng Hồi sức Châu Âu:
+ Tăng kali máu nhẹ: 5,5 – 5,9 mmol/L
+ Tăng kali máu trung bình: 6,0 – 6,4 mmol/L
+ Tăng kali máu nặng: ≥ 6,5 mmol/L
Điện tâm đồ tăng Kali máu trong BTM có gì đặc biệt?
Đó chính là tam chứng suy thận mạn trên ECG. Tam chứng này quan sát rõ khi STM giai đoạn cuối có tăng Kali máu cao.
Tam chứng suy thận mạn gồm:
+ Sóng P dẹt hoặc mất, PR dài ra
+ Sóng T cao nhọn
+ QRS biến dạng
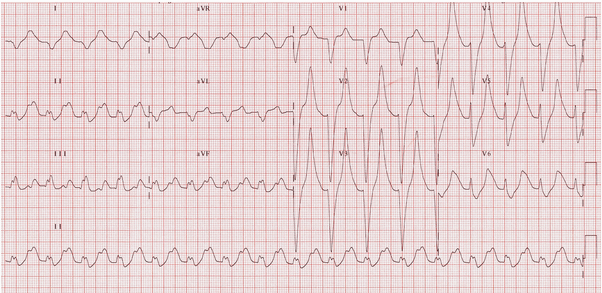
Hình ảnh ECG điển hình của tăng Kali máu.
Biến chứng nguy hiểm nhất của tăng Kali máu là gì?
Đó là rung thất, ngưng tim (biến chứng tim mạch là đáng sợ nhất). Ở bài học này tôi không bàn sâu về vấn đề tăng Kali máu.
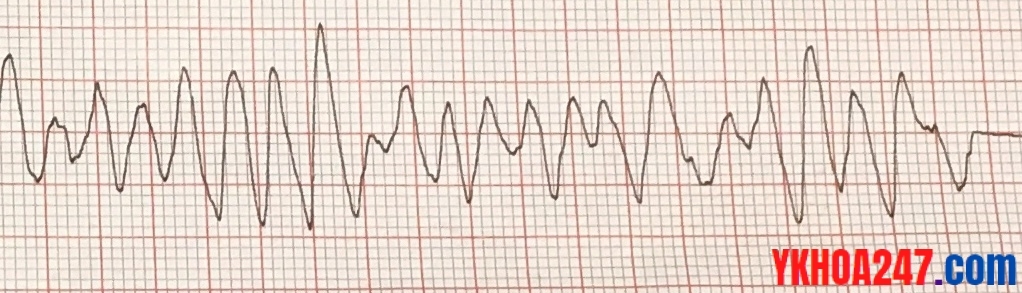
Hình ảnh rung thất trên ECG
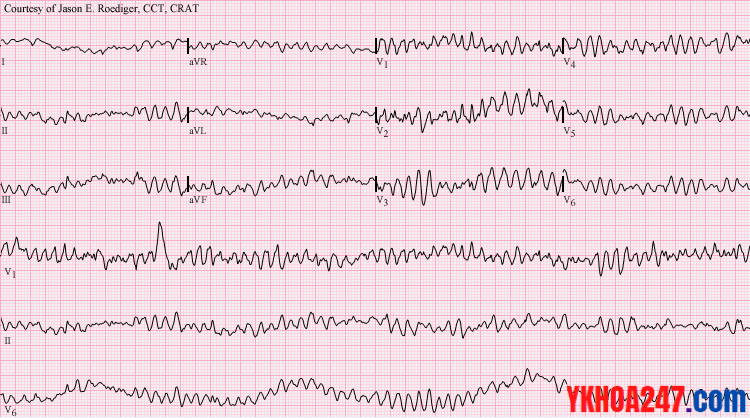
Điện tâm đồ một bệnh nhân rung thất. Tăng Kali máu cao ≥ 6,5 mmol/L có thể là nguyên nhân biến đổi ECG ở bệnh nhân này.
Có phải cứ suy thận mạn là Kali máu bệnh nhân phải tăng?
Không phải vậy. Khi suy thận mạn, thận vẫn có khả năng bài tiết kali qua việc tăng tiết aldosteron làm tăng thải kali tại ống lượn xa và tăng thải kali qua đường tiêu hóa. Do vậy, kali chỉ tăng vào giai đoạn cuối của suy thận.
Trường hợp nào mà trong suy thận mạn, mức lọc cầu thận bệnh nhân còn tốt nhưng Kali máu vẫn tăng?
Với câu hỏi này thì bạn nên khai thác thêm từ bệnh nhân.
Nếu tăng kali xảy ra sớm hơn, thường do tăng nhập kali từ chế độ ăn, tăng dị hóa đạm, tán huyết, xuất huyết, truyền máu dự trữ, toan chuyển hóa hoặc dùng thuốc làm tăng kali như thuốc ức chế men chuyển, thuốc ức chế thụ thể, thuốc lợi tiểu giữ kali như spironolactone, trialerene.
Ngoài ra, còn một số bệnh thận căn nguyên làm tổn thương vùng ống thận xa, tổn thương cơ chế bài tiết kali của thận sẽ làm tăng kali ngay cả khi không suy thận hoặc chỉ suy thận nhẹ như hội chứng giảm aldosterone – giảm renin máu, đái tháo đường, bệnh thận mô kẽ, bệnh thận do hồng cầu liềm.
Trong suy thận mạn bệnh nhân có thể bị hạ Kali máu không?
Tất nhiên là có, nhưng giảm kali ít gặp hơn trong bệnh thận mạn và nguyên nhân chủ yếu do giảm nguồn nhập kali, đi kèm với việc dùng lợi tiểu quai (Furosemid) quá liều hoặc tăng mất kali qua đường tiêu hóa.
Việc bổ sung kali sẽ được tính toán tùy thuộc vào lượng kali thiếu trong máu và lượng kali bài tiết mỗi ngày trong nước tiểu, điều này giúp tránh nguy cơ tăng kali máu.
Tại sao Natri máu thường giảm?
Nồng độ natri máu thường giảm do bị giữ nước làm natri bị hòa loãng, mặc dù natri tổng lượng có thể tăng.
Thực tế là đa số Natri máu nằm trong khoảng bình thường do biên độ dao động lớn.
Tại sao suy thận mạn lại có thể gây giảm Calci máu?
Thận suy làm giảm enzyme 1 alpha-hydroxylase, enzym này có tác dụng chuyển hóa calcidiol thành calcitriol. Calcitriol có hoạt tính sinh học mạnh, có chức năng hoạt hóa receptor hấp thu calci ở ruột và tăng tái hấp thu calci ở ống thận. Nên khi bị suy thận mạn sẽ làm giảm hấp thu calci ở ruột và giảm tái hấp thu ở ống thận => giảm calci máu.
Phosphat máu tăng: tăng dần theo mức độ suy thận, tuy nhiên ở giai đoạn đầu thì khó phát hiện, thường xuất hiện từ giai đoạn 4 trở đi.
Vì sao calci và phosphat máu lại ít thay đổi trên bệnh nhân bị suy thận mạn?
Bởi vì khi nồng độ calci huyết thanh giảm sẽ dẫn đến tăng tiết hormone tuyến cận giáp (cường cận giáp thứ phát). Hormone tuyến cận giáp có tác động mạnh đến thận nhằm loại bỏ phosphat (hiệu ứng phosphaturic), giúp tái hấp thu tối đa hóa canxi ở ống thận. Bên cạnh đó, hormone giáp cũng có tác dụng huy động calci từ xương vào máu.
Vậy làm sao để phát hiện sự rối loạn calci và phosphat do suy thận mạn?
Muốn phát hiện rối loạn calci và phosphat máu do suy thận mạn, bạn có thể làm xét nghiệm định lượng Hormone PTH, trong trường hợp có rối loạn thì nồng độ PTH máu sẽ tăng. Tuy nhiên, trên thực hành lâm sàng ít khi chúng ta phải làm xét nghiệm này ở trên bệnh nhân suy thận mạn vì ít có ý nghĩa.
Vì sao phải hạ phosphat máu ở bệnh nhân suy thận mạn có tình trạng tăng phosphat máu?
Bởi vì tăng phosphat máu là một trong những yếu tố nguy cơ quan trọng nhất liên quan đến bệnh tim mạch ở bệnh nhân suy thận mạn. Cơ chế chính xác vẫn chưa rõ ràng. Tăng phosphat máu được cho là nguyên nhân đến cường tuyến cận giáp và vôi hóa mạch máu làm tỷ lệ tử vong do bệnh tim mạch.
Các xét nghiệm khác:
– Nồng độ hormon tuyến cận giáp (PTH) tăng và có tương quan nghịch với giảm mức lọc cầu thận. Nhiều trường hợp cường chức năng tuyến cận giáp nặng, dẫn tới lắng đọng calci ở nhiều tổ chức như phổi, da, cơ và các cơ quan khác. Một số bệnh nhân lọc máu chu kỳ, tình trạng cường chức năng tuyến cận giáp nặng đòi hỏi phải cắt tuyến cận giáp. Tăng PTH còn gây nhiễm độc tủy xương, góp phần làm tăng thiếu máu và làm giảm đáp ứng với điều trị thiếu máu bằng erythropoietin.
– Nồng độ bicarbonat máu giảm, pH máu giảm khi có suy thận nặng, là biểu hiện của nhiễm toan chuyển hóa. Khi pH máu dưới 7,2 và/hoặc bicarbonat máu dưới 16 mmol/l, đòi hỏi phải điều trị bằng các chất kiềm.
Tại sao suy thận mạn lại có thể gây cường tuyến cận giáp?
Bởi vì trong suy thận mạn, việc hạ calci máu và tăng phosphat máu đều kích thích sự phì đại của tuyến cận giáp và kết quả là tăng sản xuất và tiết hormon cận giáp. Những hững thay đổi trong chuyển hóa canxi có thể dẫn đến chứng loạn dưỡng xương (bệnh xương do thận) và có thể dẫn đến lắng đọng canxi khắp cơ thể (ví dụ, vôi hóa di căn).
Cách điều trị cường tuyến cận giáp trên lâm sàng gồm những gì?
Trên thực tế, cường tuyến cận giáp, hạ calci huyết và tăng phosphat máu có thể liên quan hoặc riêng lẻ. Chúng ta có thể điều trị bằng canxi cacbonat hoặc canxi axetat uống, liệu pháp vitamin D đường uống và chất kết dính photphat đường uống (ví dụ: canxi cacbonat, axetat canxi, sevelamer hoặc lantan cacbonat).
Tại sao suy thận mạn lại gây ngứa?
Thực chất thì lâm sàng ít gặp bệnh nhân STM có ngứa. Ngứa có thể là do nhiều nguyên nhân, nhất là do dị ứng.
Ngứa trong STM được giải thích: Do cường tuyến cận giáp thứ phát và sự lắng đọng calci ở dưới da => kích thích thụ thể => ngứa.
Tại sao suy thận mạn lại có thể ảnh hưởng đến chức năng tình dục?
Bởi vì tăng urê máu có thể dẫn đến bất lực ở nam giới hoặc vô sinh (ví dụ như rụng trứng, vô kinh) ở phụ nữ do kết quả của việc điều hòa hormone sinh dục bị rối loạn.
Tại sao suy thận mạn có thể gây nhiễm toan chuyển hóa?
Toan chuyển hóa chủ yếu là do thận suy làm giảm quá trình bài xuất ion H+ và tái hấp thi ion HCO3- ở ống lượn gần và ống lượn xa.
Xét nghiệm nước tiểu
Có thể chỉ định 10 TSNT, định lượng protein niệu hay Microalbumin niệu.
Microalbumin niệu có thể được chỉ định, xét nghiệm này có ý nghĩa trong chẩn đoán, điều trị và tiên lượng bệnh thận mạn. Những điểm chính về Microalbumin niệu bạn có thể tham khảo tại đây.
Protein niệu thường có, nếu do bệnh cầu thận thì lượng protein niệu thường 2-3 g/24 giờ khi suy thận còn nhẹ. Suy thận giai đoạn cuối, lượng protein niệu ít đi khoảng 1g/24 giờ, do lượng nước tiểu giảm. Nếu do hội chứng thận hư thì protein niệu nhiều (lớn hơn hoặc bằng 3,5 g/24 giờ).
Protein niệu trong suy thận mạn thường ít có ý nghĩa trong chẩn đoán, có ý nghĩa trong bệnh lý viêm cầu thận và hội chứng thận hư hơn. Tuy nhiên bạn phải để ý đến albumin niệu vi lượng trong bệnh thận đái tháo đường, albumin niệu có giá trị tiên lượng BTM.
Hồng cầu niệu thường có ở những bệnh nhân bị suy thận mạn do bệnh lý cầu thận.
Hồng cầu niệu thường không có nghĩa chẩn đoán trong suy thận mạn, khi xét nghiệm hồng cầu niệu dương tình thì bạn nên nghĩ đến bệnh lý viêm cầu thận, sỏi thận, u thận nhiều hơn.
Bạch cầu niệu và vi khuẩn niệu: khi suy thận do viêm thận bể thận mạn thì có thể có bạch cầu niệu nhiều và có thể có vi khuẩn niệu.
Nếu bạch cầu niệu dương tính thì bạn nên nghĩ ngay đến nhiễm khuẩn đường tiết niệu.
Trụ niệu: có thể thấy trụ hạt hoặc trụ trong, trụ thường có kích thước to, đường kính của trụ lớn hơn hai lần đường kính của một bạch cầu đa nhân. Khi có 2/3 số trụ trở lên là trụ to, là dấu hiệu rất có giá trị để chẩn đoán đây là suy thận mạn.
Tỉ trọng và độ thẩm thấu nước tiểu: thường ít giá trị trên lâm sàng.
Số lượng nước tiểu: Trên lâm sàng, thường thì suy thận giai đoạn cuối thì lượng nước tiểu mới giảm.
Theo dõi lượng nước tiểu 24h rất quan trọng. Tuy nhiên đôi khi không được chính xác vì nhiều bệnh nhân không tuân thủ đúng hướng dẫn cách lấy nước tiểu 24h.
Hơn nữa, nhiều bệnh nhân suy thận mạn được điều trị bằng lợi tiểu để hạ huyết áp => lượng nước tiểu 24h chưa phản ánh chính xác suy chức năng thận.
Các xét nghiệm chẩn đoán hình ảnh
X quang bụng
Thường giúp phát hiện sỏi thận hơn. Việc xác định bóng thận nhỏ giúp nghi ngờ bệnh lý suy thận mạn. Tuy nhiên, vai trò của X quang trong suy thận mạn rất hạn chế.
Siêu âm thận
Trả về kết quả: thường thì hai thận teo nhỏ đều hoặc không đều. Điều này khẳng định một diễn tiến mạn tính trong suy thận mạn.
+ Nếu suy thận mạn do viêm cầu thận mạn hai thận nhỏ đều hai bên, nhu mô thận tăng âm làm xóa mờ ranh giới giữa nhu mô thận và đài bể thận.
+ Nếu suy thận do viêm thận-bể thận mạn thấy hai thận teo nhỏ không đều, chu vi thận lồi lõm.
+ Bệnh nhân suy thận do bệnh thận đa nang thì thấy thận to, nhiều nang ở hai thận.
Một số đặc điểm siêu âm trên bệnh nhân suy thận mạn:
+ Giảm độ dày vỏ thận <6 mm => đáng tin cậy hơn chiều dài thận
+ Giảm chiều dài thận
+ Tăng hồi âm âm vỏ thận (increased echogenicity)
+ Sẹo thận
+ Khó quan sát tháp thận và xoang thận
+ Vôi hóa nhú thận
+ Nhiều nang thận (multiple cysts)

Thận phải của một bệnh nhân nữ 10 năm trước khi phát hiện suy thận mạn
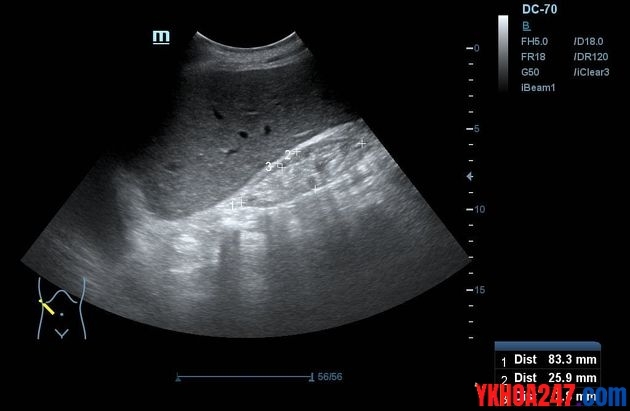
10 năm sau: Hình ảnh thận teo trong suy thận mạn. Kích thước thận nhỏ hơn, giảm độ dày vỏ thận, tăng hồi âm vỏ thận, khó phân biệt với lớp mỡ quanh thận.
Siêu âm thận rất hữu ích để xác định kích thước và hình dạng của thận, đồng thời giúp chúng ta đánh giá tình trạng thận ứ nước hoặc tắc nghẽn niệu quản và bàng quang. Điều này có thể xảy ra do sỏi thận, sỏi niệu quản, bệnh lý thần kinh, phì đại tuyến tiền liệt, xơ hóa sau phúc mạc, khối u ở bụng (thứ phát sau ung thư cổ tử cung hoặc tuyến tiền liệt) hoặc các bất thường khác về cấu trúc. Thận nhỏ, thận teo là biểu hiện chứng tỏ diễn tiến mạn tính, không thể đảo ngược được.
Chẩn đoán
Bệnh thận mạn có phổ biến trong cộng đồng không?
Bệnh thận mạn rất phổ biến trong cộng đồng. Trung bình cứ 10 người thì có khoảng 1 người mắc bệnh ở các giai đoạn khác nhau trên toàn thế giới.
Tại sao chúng ta cần chẩn đoán sớm bệnh thận mạn?
Bởi vì thận có khả năng hoạt động bù trừ rất tốt, nên hiếm khi có triệu chứng lâm sàng. Nếu bệnh nhân của bạn đã có triệu chứng lâm sàng thì tiên lượng xấu vì suy thận thường ở giai đoạn cuối. Do đó, chúng ta cần phải chẩn đoán sớm hơn để điều trị, làm chậm tiến triển của suy thận mạn.
Ở những bệnh nhân suy thận mạn giai đoạn cuối, biểu hiện của bệnh có thể xen kẽ với:
– Triệu chứng bệnh căn nguyên: THA, ĐTĐ
– Triệu chứng tại thận: tiểu máu, phù, đau hông lưng, tiểu khó, tiểu rắt
– Triệu chứng của suy thận mạn giai đọan cuối: thiếu máu, nhức đầu, buồn nôn, nôn, chán ăn, tiểu ít, hơi thở có mùi urê, khó thở ….
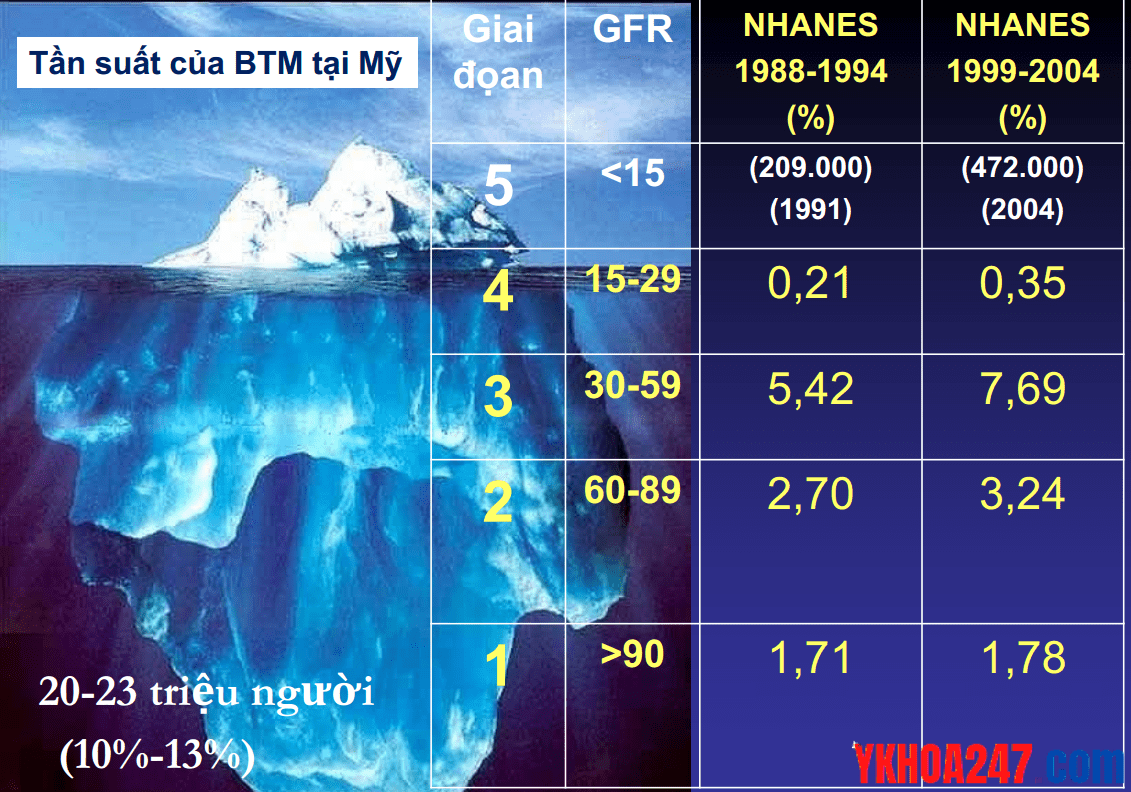
Nguyên lý “tảng băng trôi” – phần nổi là những người suy thận mạn giai đoạn IV, V mới bộc lộ triệu chứng rõ ràng.
Tiêu chuẩn chẩn đoán bệnh thận mạn
Dựa vào 1 trong 2 tiêu chuẩn sau:
Triệu chứng tổn thương thận (có biểu hiện 1 hoặc nhiều)
+ Có Albumine nước tiểu (tỷ lệ albumin creatinine nước tiểu > 30mg/g hoặc albumine nước tiểu 24 giờ >30mg/24giờ)
+ Bất thường nước tiểu
+ Bất thường điện giải hoặc các bất thường khác do rối lọan chức năng ống thận
+ Bất thường về mô bệnh học thận
+ Xét nghiệm hình ảnh học phát hiện thận tiết niệu bất thường
+ Ghép thận
Giảm mức lọc cầu thận (Glomerular filtration rate: GFR) < 60ml/ph/1,73 m2 (xếp lọai G3a – G5)
Với mức lọc cầu thận được đánh giá dựa vào độ thanh lọc creatinine ước tính theo công thức Cockcroft Gault hoặc dựa vào độ loc cầu thận ước tính (estimated GFR, eGFR) dựa vào công thức MDRD.
+ Công thức Cockcroft Gault ước đoán ĐTL creatinin từ creatinin huyết thanh
+ Công thức MDRD (Modification of Diet in Renal Disease Study) ước đoán mức lọc cầu thận (estimated GFR, eGFR) từ creatinin huyết thanh
+ Công thức tính mức lọc cầu thận theo creatinin nội sinh.
Chẩn đoán suy thận mạn
Tiêu chuẩn chẩn đoán suy thận mạn cũng chính là định nghĩa của suy thận mạn.
Trên thực tế lâm sàng chúng ta thường dựa vào hội chứng tăng urê máu để gợi ý, tính mức lọc cầu thận để chẩn đoán xác định giai đoạn suy thận mạn.
Phân chia giai đoạn
Năm 2012, KDIGO (Kidney Disease Improving Global Outcomes) của Hội Thận học Quốc Tế, giai đoạn 3 được tách thành 3a và 3b, kèm theo bổ sung albumine niệu vào trong bảng phân giai đoạn hỗ trợ cho việc đánh giá tiên lượng và tiến triển của BTM.
Bạn để ý là các giai đoạn của suy thận mạn nằm trong các giai đoạn của bệnh thận mạn (từ G3a – G5).
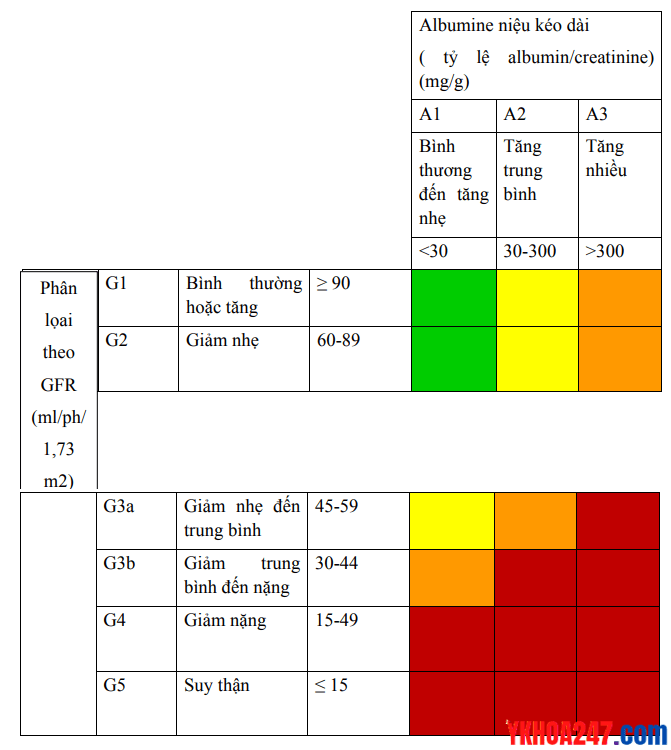
Nguy cơ bệnh thận mạn và kế hoạch tái khám

Cần lưu ý mức lọc cầu thận chỉ phản ảnh chính xác giai đoạn BTM khi chức năng thận ổn định (không thay đổi trong 3 tháng xét nghiệm lặp lại) và sau khi đã loại bỏ các yếu tố làm nặng thêm tạm thời tình trạng suy thận.
Chẩn đoán phân biệt
Bạn cần chẩn đoán phân biệt với tổn thương thận cấp và đợt cấp của suy thận mạn.
Đợt cấp của bệnh thận mạn là gì?
Đó chính là một tổn thương thận cấp tính trên nền một bệnh nhân bị BTM đã lâu.
Cho nên bệnh nhân vừa có các biểu hiện của tổn thương thận cấp, vừa có biểu hiện của bệnh thận mạn:
+ Dấu chứng tổn thương thận cấp (creatinin huyết tăng vọt so với creatinine nền, thiểu niệu hay vô niệu, hội chứng tăng urê máu cấp tính).
+ Dấu chứng ủng hộ bệnh thận mạn (thận teo trên siêu âm + thiếu máu,…).
Khi đã xác định bệnh nhân đang ở đợt cấp của bệnh thận mạn, chúng ta nên tầm soát gì?
Trước mọi trường hợp tăng đột ngột creatinin ở người bệnh bệnh thận mạn hoặc trước mọi trường hợp người bệnh có creatinine huyết thanh tăng lúc nhập viện mà không biết creatinine huyết thanh cơ bản, cần tầm soát các yếu tố làm nặng thêm hoặc đang thúc đẩy tình trạng suy thận:
+ Giảm thể tích máu lưu thông: mất dịch, mất máu, suy tim sung huyết.
+ Thay đổi huyết áp như tăng hoặc hạ huyết áp (thường do thuốc hạ áp).
+ Nhiễm trùng.
+ Tắc nghẽn đường tiểu.
+ Thuốc độc cho thận: aminoglycoside, kháng viêm non steroid, thuốc cản quang.
+ Biến chứng mạch máu thận: tắc động mạch thận do huyết khối, hẹp động mạch thận, thuyên tắc động mạch thận do cholesterol…
Phân biệt suy thận mạn giai đoạn giai đoạn cuối và đợt cấp suy thận mạn
Muốn phân biệt 2 trường hợp này, chúng ta có thể dựa vào:
+ Nếu bệnh nhân có hội chứng tăng urê máu xuất hiện rầm rộ, có các yếu tố thuận lợi thì nên nghĩ đến đợt cấp suy thận mạn.
+ Trong bệnh suy thận mạn giai đoạn cuối, các biểu hiện hội chứng tăng urê máu thường không rầm rộ bằng.
Nếu tiền sử bệnh nhân đã được chẩn đoán suy thận mạn giai đoạn cuối thì không cần phải phân biệt nữa.
Chẩn đoán phân biệt giữa suy thận mạn và tổn thương thận cấp
Xem thêm tại đây.
Tại sao lại cần chẩn đoán phân biệt tổn thương thận cấp với đợt cấp suy thận mạn?
Nếu người bệnh có tăng creatinin huyết thanh, cần phân biệt bệnh thận mạn với tổn thương thận cấp vì tổn thương thận cấp có khả năng hồi phục chức năng thận nếu được chẩn đoán sớm và can thiệp kịp thời.
– Dựa vào creatinin huyết thanh nền trước đây
+ Nếu creatinin huyết thanh nền trong vòng 3 tháng trước đây, nếu ở mức bình thường thì có thể nghĩ đến tổn thương thận cấp.
+ Nếu creatinin huyết thanh nền trước đây đã tăng mạn tính trên 3 tháng, sẽ là bằng chứng quan trọng của bệnh thận mạn.
+ Nếu không biết creatinine huyết thanh nền trước đây, vẫn có thể cả 2 bệnh lý trên kết hợp gây tổn thương thận cấp trên nền bệnh thận mạn. Trong trường hợp này, cần theo dõi creatinin huyết thanh trong nhiều ngày liên tiếp kết hợp với các bằng chứng cận lâm sàng khác sẽ giúp chẩn đoán phân biệt.
– Dựa vào siêu âm đo kích thước 2 thận: người bệnh tổn thương thận cấp, hai thận có kích thước bình thường hoặc to.
– Sinh thiết thận: Cần cân nhắc kỹ khi chưa chẩn đoán phân biệt được với tổn thương thận cấp.
Trên thực tế lâm sàng, nhiều trường hợp chúng ta sẽ không biết được mức creatinin nền của bệnh nhân, chẩn đoán phân biệt thường dựa vào tiền sử bệnh và siêu âm đo kích thước thận. Sinh thiết thận thường không được sử dụng vì có nhiều biến chứng và tạo tâm lý lo sợ cho bệnh nhân.
Biến chứng của bệnh thận mạn
Các biến chứng của bệnh thận mạn có thể xuất hiện sớm từ giai đoạn 2. Nếu bệnh nhân đang ở giai đoạn nặng thì số lượng biến chứng càng nhiều. Vì vậy chúng ta cần phải đánh giá biến chứng ở bệnh nhân có MLCT <60ml/phút/m2 để có thể tầm soát và điều trị kịp thời.
Nhìn chung, những biến chứng của bệnh thận mạn dưới đây đã được tôi bàn luận xuyên suốt ở những phần trên.
+ Biến chứng THA: đây có thể là nguyên nhân, lẫn hậu quả của BTM.
+ Thiếu máu mạn: đây chính là hậu quả của BTM chủ yếu do giảm tiết EPO.
+ Tình trạng suy dinh dưỡng: đây là biến chứng hay gặp ở những bệnh nhân BTM giai đoạn cuối.
+ Rối loạn chuyển hóa calci và phosphat: gây nên nhiều bệnh lý về xương.
+ Bệnh lý thần kinh: Các chất thải bị tích tụ trong BTM có thể gây tác động lên cả thần kinh TW, thần kinh ngoại biên và TK thực vật theo nhiều mức độ khác nhau.
+ Bệnh lý tim mạch: Bệnh nhân BTM thường có nhiều yếu tố nguy cơ của bệnh lý tim mạch.
+ …
Bạn cần chú ý là những biến chứng trên rất thường hay xuất hiện trên bệnh nhân ESRD.
Tại sao suy thận mạn có thể gây suy tim?
Bởi vì suy thận mạn gây giữ nước, muối, THA, thiếu máu… làm cho tim phải tăng cường hoạt động nhiều hơn so với bình thường, về lâu dài có thể làm cho tim trở nên yếu hơn gây nên tình trạng suy tim.
Để ý là muốn có suy tim thì suy thận mạn phải diễn tiến lâu dài và âm thầm. Tuy nhiên, thời gian gây nên suy tim phụ thuộc vào từng đối tượng cụ thể khác nhau.
Vì sao bệnh nhân BTM lại có nguy cơ cao mắc bệnh mạch máu (mạch vành, TBMMN, bệnh mạch máu ngoại biên)?
Bệnh mạch máu gia tăng trên bệnh nhân bệnh thận mạn do bệnh thận mạn có kèm những yếu tố nguy cơ tim mạch kinh điển (tăng huyết áp, tăng thể tích tuần hoàn, rối loạn lipid máu, tăng hoạt tính giao cảm) và cả những yếu tố nguy cơ tim mạch “không kinh điển” (thiếu máu, tăng phosphat máu, cường tuyến cận giáp, tăng homocystein máu, tăng phản ứng viêm toàn thân như tăng C reactive protein, giảm albumine, giảm fetuin).
Phản ứng viêm toàn thân gây tăng nguy cơ tắc mạch, tăng quá trình vôi hóa mạch máu nhất là khi có kèm tăng phosphat máu.
Tại sao bệnh nhân suy thận mạn lại dễ nhiễm trùng hơn người bình thường?
Trên thực tế, bệnh nhân suy thận mạn nhạy cảm với nhiễm trùng hơn người bình thường, có thể là do giảm chức năng bạch cầu do suy dinh dưỡng, toan chuyển hóa, môi trường tăng urê máu và do teo hạch lympho.
Tuy dễ nhiễm trùng nhưng bệnh nhân suy thận mạn ít sốt vì vùng trung tâm điều nhiệt bị ức chế bởi urê máu cao. Vậy nên, bạn cần phải thận trọng ở những trường hợp này.
Tại sao những người đái tháo đường kèm suy thận (bệnh thận đái tháo đường) thì phải giảm liều Insullin?
Bởi vì Insullin được thải trừ qua thận, mà khi bệnh nhân bị suy thận nên lượng Insullin được đào thải kém và nó sẽ tăng nhẹ hoặc trung bình trên bệnh nhân suy thận => cần giảm liều insullin.
Nếu bạn không giảm liều Insullin thì bệnh nhân có nguy cơ hạ đường huyết hơn.
Cũng chính vì vậy khi điều trị tăng Kali máu trong suy thận mạn, chúng ta thường dùng Insullin nhanh kết hợp Glucose TTM để tránh hạ đường huyết.
Tại sao bệnh nhân STM giai đoạn cuối (ESRD) thường hay bị suy dinh dưỡng?
Bởi vì bệnh nhân ESRD thường ăn uống kém, tình trạng kém hấp thu, bên cạnh đó bệnh nhân phải tuân thủ chế độ ăn kiêng giảm đạm. Lưu ý, chế độ ăn kiêng ở những bệnh nhân này nên cung cấp ít nhất 30 đến 35 Kcal / kg mỗi ngày để đảm bảo đủ năng lượng.
Tiến triển của bệnh thận mạn
Tiến triển của bệnh thận mạn như thế nào?

Bệnh thận mạn có tiến triển suy giảm chức năng thận chậm trong nhiều năm và không hồi phục cho đến giai đoạn cuối. Nếu người bình thường không bị bệnh thận, sau 30 tuổi, mỗi năm theo sinh lý, mức lọc cầu thận giảm trung bình 1ml/phút/1,73 m2. Bệnh thận mạn được gọi là tiến triển nhanh khi mỗi năm mất ≥ 5 ml/phút (theo KDIGO 2012).
Suy thận mạn cũng được xem như là kẻ giết người thầm lặng, từ từ làm giảm chức năng thận, đến khi bệnh nhân vào viện thì đã quá muộn rồi. Thận đã bị xơ hóa và teo nhỏ. Đòi hỏi phải điều trị thay thế thận.
Điều trị
Nói đến điều trị bệnh thận mạn khó có thể nói hết được. Tùy thuộc vào giai đoạn bệnh thận mạn mà ta có cách điều trị khác nhau. Tôi sẽ phân chia thành điều trị BTM trước giai đoạn cuối và điều trị bệnh thận mạn giai đoạn cuối.
Suy thận mạn là kết cục của bệnh thận mạn, cho nên điều trị cho bệnh nhân suy thận mạn chính là điều trị bệnh thận mạn.
Nguyên tắc cần nhớ:
BTM trước giai đoạn cuối: Điều trị bảo tồn, điều trị nội khoa.
BTM giai đoạn cuối: Phải tiến hành điều trị thay thế thận (vì điều trị nội khoa không còn hiệu quả nữa).
Điều trị phải cá nhân hóa.
Điều trị bệnh thận mạn trước giai đoạn cuối
Để hiểu bệnh thận mạn trước giai đoạn cuối là gì, tôi xin nhắc lại định nghĩa bệnh thận mạn giai đoạn cuối.
Bệnh thận mạn giai đoạn cuối (end stage renal disease, ESRD) là bệnh thận mạn giai đoạn 5. Đây là giai đọan nặng nhất của bệnh thận mạn (BTM) với mức lọc cầu thận (GFR) < 15mL/ph/1,73 m2, biểu hiện bằng hội chứng urê máu và tình trạng này sẽ gây tử vong nếu không được điều trị thay thế thận.
Như vậy, BTM trước giai đoạn cuối gồm bệnh thận mạn giai đoạn 1 đến 4. Mức lọc cầu thận ở trong giai đoạn này còn ở mức chấp nhận được.
Mục đích điều trị BTM trước giai đoạn cuối đó là gì?
Mục đích cho cùng của điều trị BTM trước giai đoạn cuối là ngăn chặn sự tiến triển của STM, kéo dài thời gian dẫn đến suy thận mạn giai đoạn cuối.
Bằng cách điều trị nguyên nhân, biến chứng và các yếu tố thúc đẩy của bệnh thận mạn, chúng ta sẽ giúp bệnh nhân có được một chất lượng cuộc sống tốt mà không cần phải điều trị thay thế thận.
Ở bài này, mỗi khía cạnh của điều trị tôi sẽ đặt câu hỏi để bàn luận thêm.
Điều trị nguyên nhân
Tùy thuộc vào nguyên nhân của suy thận mạn mà chúng ta sẽ có hướng điều trị cụ thể.
Bạn có thể tham khảo thêm tại những bài viết cụ thể.
Điều trị tăng huyết áp ở bệnh nhân bệnh thận mạn
Mục đích điều trị hạ huyết áp
Hai mục đích chính trong việc điều trị hạ huyết áp ở bệnh nhân BTM là:
+ Chậm tiến triển bệnh thận mạn đến suy thận.
+ Giảm nguy cơ tim mạch.
Nên ưu tiên nhóm thuốc hạ huyết áp nào trên bệnh nhân bệnh thận mạn?
Các loại thuốc không chỉ làm hạ huyết áp mà còn làm giảm protein niệu được khuyến cáo là lựa chọn đầu tiên cho phần lớn bệnh nhân bệnh thận mạn và tăng huyết áp, các nghiên cứu cho thấy có lợi ích lâu dài trên tim mạch và thận khi protein niệu giảm.
Thuốc tác động lên hệ renin- angiotesin-aldosteron (RAAS) như ức chế men chuyển (ACEI) hoặc ức chế thụ thể angiotesin (ARB) được khuyến cáo là lựa chọn đầu tiên cho quần thể bệnh nhân này.
Trong BTM, tùy trường hợp cụ thể mà chúng ta ưu tiên các nhóm thuốc khác nhau, trên thực tế ở nước ta, thường ưa chuộng ACEI/ARB vì làm giảm protein niệu tốt, có lợi ích lâu dài trên tim mạch và thận.
Khuyến cáo lựa chọn thuốc điều trị tăng huyết áp ở bệnh nhân bệnh thận mạn
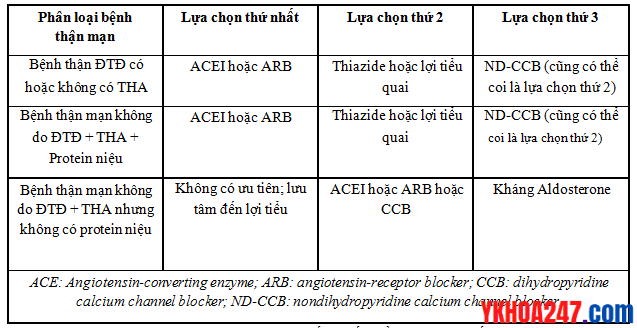
Bảng khuyến cáo lựa chọn thuốc hạ huyết áp theo từng nhóm bệnh nhân
Vai trò của ACEI/ARB trong việc hạ huyết áp ở bệnh nhân suy thận mạn
Các nghiên cứu cho thấy thuốc điều trị tăng huyết áp tác động lên hệ renin-angiotensin có tác dụng dự phòng giảm chức năng thận hơn các nhóm thuốc khác. Kết quả này thể hiện đầu tiên ở bệnh nhân protein niệu, trong khi hiệu quả thấp hơn ở bệnh nhân không có protein niệu.
Dựa vào kết quả này, K/DOQI khuyến cáo sử dụng ACEI hoặc ARB như là lựa chọn đầu tiên ở bệnh nhân bệnh thận đái tháo đường hoặc bệnh thận không do đái tháo đường nhưng có tăng huyết áp và protein niệu.
Các nghiên cứu cho thấy ACEI và ARB có hiệu quả tương đương trong hạ huyết áp và giảm protein niệu.
Losartan 50 mg
Kết hợp giữa Ibersartan 150mg và Hydroclorothiazide 12.5 mg làm tăng hiệu quả bảo vệ thận và điều trị tốt tăng huyết áp.
Ibersartan 150 mg: giảm protein niệu, bảo vệ chức năng thận

Lisinopril 10 mg

Ramipril 10 mg là thuốc UCMC bảo vệ thận tốt nhưng chưa phổ biến ở Việt Nam

Captopril 25 mg cũng giúp bảo tồn chức năng thận
Có nên kết hợp ACEI/ARB không?
Điều trị kết hợp cả ACEI và ARB không được khuyến cáo vì sự kết hợp này cho thấy làm xấu đi chức năng thận.
Sự kết hợp ACEI và ARB không làm giảm các biến cố và tử vong tim mạch khi so sánh liệu pháp đơn trị liệu với ACEI.
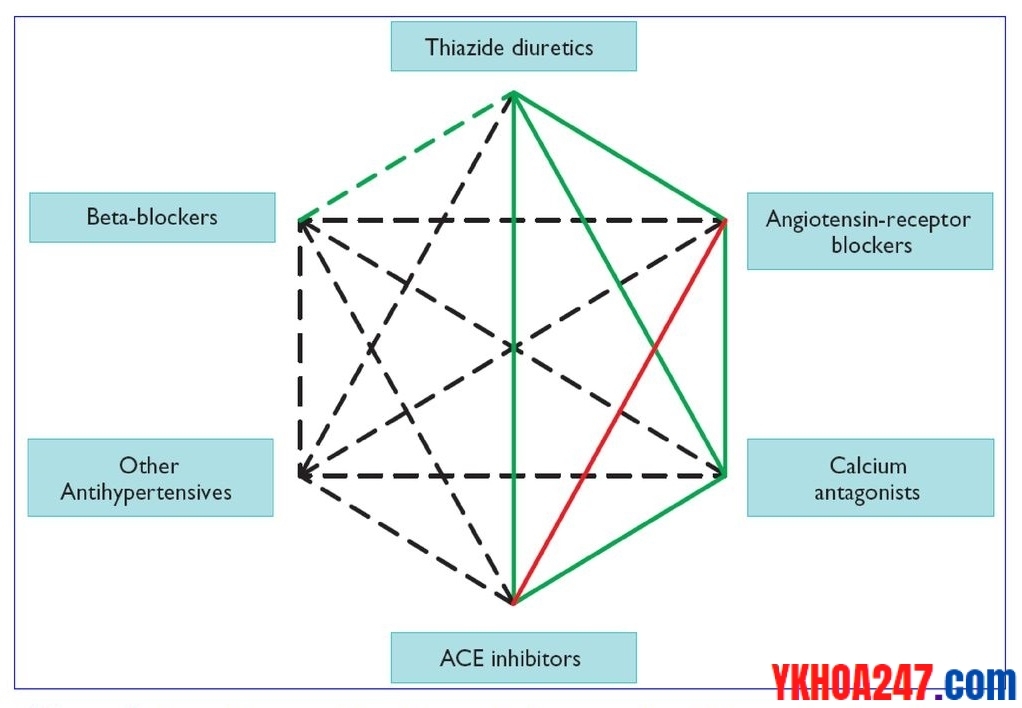
Gạch màu đỏ: không phối hợp UCMC với chẹn thụ thể (không phối hợp 2 thuốc có cơ chế tác dụng gần tương tự nhau)
Chọn ức chế men chuyển hay chẹn thụ thể để điều trị THA ở bệnh nhân suy thận mạn?
Việc ưu tiên lựa chọn thuốc này hơn thuốc kia phụ thuộc vào từng bệnh nhân cụ thể, cần cân nhắc thêm các yếu tố khác và khả năng xảy ra các phản ứng có hại.
Nhìn chung, các thuốc ức chế men chuyển và thuốc ức chế thụ thể AT1 dung nạp tốt. Các thuốc ức chế men chuyển có thể gây ho khan khó chịu, trong nhiều trường hợp cần phải thay đổi điều trị. Các thuốc ức chế thụ thể AT1 không gây ho khan. Trường hợp phù mạch tuy ít khi gặp nhưng cần thông báo với bệnh nhân bắt đầu điều trị với thuốc ức chế men chuyển hoặc ức chế thụ thể AT1 về một số dấu hiệu và triệu chứng xuất hiện cùng phù mạch.
Trên lâm sàng, lựa chọn ACEI hay ARB vẫn còn phụ thuộc vào kinh nghiệm của bác sĩ. Tuy nhiên, xu hướng thường là chọn ACEI bởi vì nhóm thuốc này thường dễ tìm kiếm trên thị trường và giá thành cũng rẻ hơn. Nếu không đáp ứng với ACEI hoặc xuất hiện tác dụng phụ ảnh hưởng đến cuộc sống thì đổi thuốc.
Cơ chế ACEI hay ARB làm hạ huyết áp?
Tham khảo cơ chế tại đây.
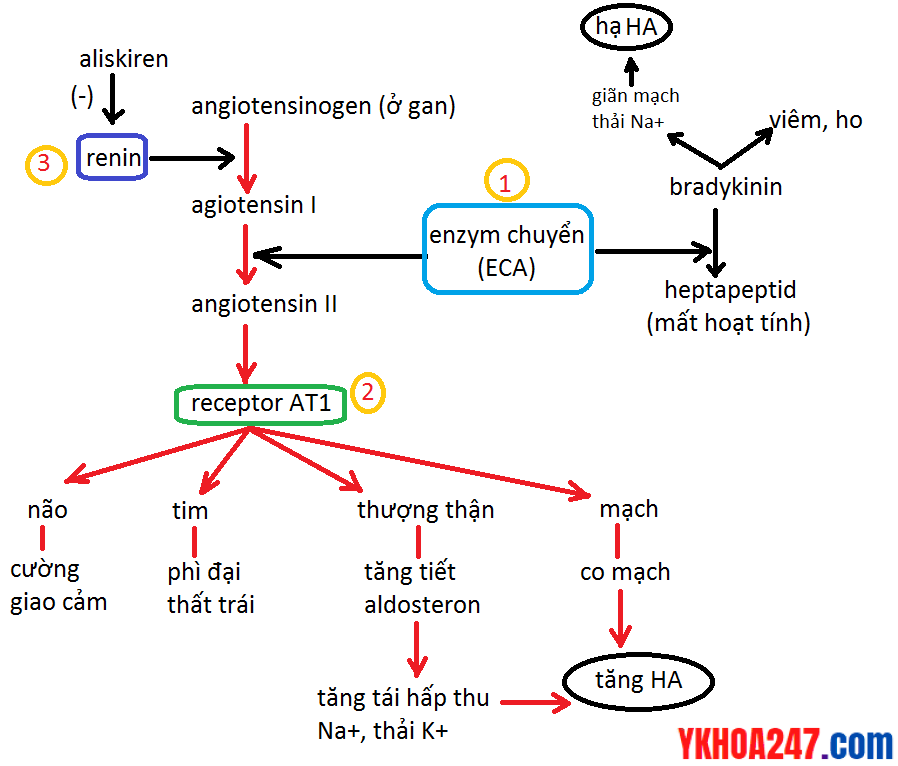
Cơ chế nhóm chức chế men chuyển
Tại sao ACEI/ARB có thể làm giảm protein niệu ở bệnh nhân suy thận mạn?
ACEI làm giãn tiểu ĐM đến và đi, đặc biệt là tiểu ĐM đi => làm giảm áp suất lọc hữu hiệu => giảm lọt albumin => làm giảm protein niệu.
Tác dụng phụ hay gặp của ACEI là gì?
– Ho
– Phù mạch
– Rối loạn vị giác
– ADR khác (đau đầu, mệt mỏi)
– Tăng Kali
– Giảm chức năng thận
– Ngứa
– Hạ huyết áp
Ức chế men chuyển có rất nhiều tác dụng phụ, tuy nhiên 2 tác dụng phụ nổi bật là ho khan và phù mạch. Do đó, khi điều trị THA với ACEI bạn nên cho bệnh nhân biết 2 tác dụng phụ này.
Tại sao ACEI lại gây tác dụng phụ ho khan?
Bởi vì khi dùng thuốc ACEI bị ức chế, bradikinin không được giáng hóa và tích lũy dẫn đến một tác dụng phụ phổ biến của nhóm thuốc này đó là gây ho. Ho này không đáp ứng với các thuốc giảm ho trung ương và cách duy nhất để khắc phục tác dụng phụ này đó là đổi thuốc => đổi sang chẹn thụ thể.

Ho khan là tác dụng phụ hay gặp nhất của thuốc ức chế men chuyển
Tại sao ACEI lại gây tác dụng phù mạch?
Thuốc ức chế men chuyển ức chế thoái giáng bradykinin như đã nêu ở trên, do đó làm tăng tích lũy bradykinin, mà bradykinin là một chất trung gian của quá trình viêm nên sẽ gây ra các triệu chứng của quá trình viêm. Từ đó gây ra tình trạng giãn mạch (chủ yếu ở hệ thống mao mạch) => dịch trong lòng mạch sẽ thoát ra ngoài => tăng tích lũy dịch ở ngoại mạch và gây phù mạch.
Không giống như phù mạch dị ứng, phù mạch do thuốc ức chế men chuyển không xuất hiện mề đay.
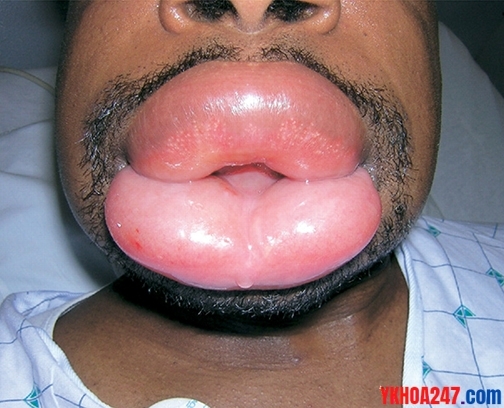
Nhận biết nhanh phù mạch do ức chế men chuyển?
Phù bừng ở mặt là dấu hiệu sớm, phù chi là dấu hiệu muộn.

Phù mạch trên một bệnh nhân sử dụng ức chế men chuyển
Bệnh nhân thường có biểu hiện sưng môi, lưỡi hoặc mặt, biểu hiện khác ít gặp hơn là đau bụng từng cơn do phù mạch ruột. Nổi mày đay và ngứa là không có.
Phù mạch trên một bệnh nhân sử dụng ức chế men chuyển
Vì sao phù mạch do ức chế men chuyển dùng kháng Histamin H1 không cải thiện?
Bởi vì phù mạch do thuốc ức chế men chuyển không liên quan tới histamine. Do đó, nó không đáp ứng với thuốc điều trị các phản ứng liên quan tới IgE. Các khuyến cáo hiện nay bao gồm dừng thuốc ức chế men chuyển và chú trọng điều trị hỗ trợ.
Tại sao dùng ACEI lại có thể gây tăng kali huyết?
Bởi vì việc sử dụng ACEI sẽ làm giảm tiết aldosterone, giảm hiệu quả bài tiết kali qua nước tiểu => dẫn đến tăng Kali máu.
Đến đây, một số bạn sẽ đặt ra câu hỏi: STM thường có tăng Kali huyết, dùng ACEI/ARB lại góp phần tăng Kali huyết, vậy thì tại sao lại ưu tiên nhóm ACEI/ARB đến thế?
Bạn cần biết rằng là tỷ lệ chung của tăng kali máu (được định nghĩa là nồng độ kali huyết thanh trên 5,5 mEq / L) ở những bệnh nhân được điều trị bằng thuốc ACEI hoặc ARB là khoảng 3,3% (khá thấp). Tuy nhiên, mức độ tăng Kali máu sẽ phụ thuộc vào từng trường hợp cụ thể:
+ Thuốc ACEI và ARB thường làm tăng nồng độ kali huyết thanh dưới 0,5 mEq / L ở những bệnh nhân có chức năng thận tương đối bình thường.
+ Tăng kali máu nổi bật hơn có thể gặp ở những bệnh nhân bị bệnh thận mạn tính, tiểu đường, sử dụng đồng thời thuốc giữ kali như thuốc lợi tiểu tiết kiệm kali hoặc thuốc chống viêm không steroid hoặc ở người lớn tuổi.
Mặc dù vậy, ACEI lại có tác dụng làm giảm protein niệu rất tốt, được xem như là thuốc bảo vệ thận. Y học bằng chứng đã chứng minh lợi ích của ACEI ở bệnh nhân STM => Do đó vẫn ưu tiên ACEI bởi vì bạn có thể kết hợp thêm lợi tiểu thải Kali (Furosemid) khi Kali máu tăng.
Khi dùng ức chế men chuyển, cần theo dõi gì trên bệnh nhân?
Bởi vì khi sử dụng thuốc ức chế men chuyển thường gây tăng Kali và có thể gây suy giảm mức lọc cầu thận nên cần phải theo dõi Kali máu và Creatinin máu.
Tại sao dùng ACEI lại có khả năng gây giảm mức lọc cầu thận? (hiếm gặp)
ACEI làm giãn tiểu ĐM đến và đi, đặc biệt là tiểu ĐM đi => làm giảm lực cầu thận, giảm GFR.
Vai trò của lợi tiểu trong việc hạ huyết áp ở bệnh nhân suy thận mạn
Nhóm lợi tiểu có thể dùng ở bệnh nhân STM là Thiazide và lợi tiểu quai Furosemide. Tuy nhiên, trên lâm sàng lại dùng Furosemide nhiều hơn ở bệnh nhân BTM.
Tại sao lại sử dụng lợi tiểu ở bệnh nhân STM để làm hạ huyết áp?
Bởi vì bệnh nhân bệnh thận mạn tăng huyết áp thường do tình trạng giữ nước và muối gây quá tải dịch. Vì vậy lợi tiểu là cần thiết trong phác đồ điều trị các trường hợp như vậy.
Tại sao lại ưu tiên sử dụng lợi tiểu quai và lợi tiểu Thiazide?
Bởi vì ở những bệnh nhân suy thận mạn có tình trạng tăng kali máu do giảm đào thải. Vì vậy cần sử dụng lợi tiểu thải Kali mà cụ thể là lợi tiểu quai và Thiazide.
Khi nào dùng lợi tiểu Thiazide ở bệnh nhân bệnh thận mạn?
Thiazide được khuyến cáo cho bệnh nhân bệnh thận mạn giai đoạn 1 – 3 (MLCT ≥ 30 ml/ph) và được chứng minh là có hiệu quả trong giảm huyết áp và nguy cơ tim mạch.

Hydroclorothiazid 25mg
Khi nào dùng lợi tiểu quai ở bệnh nhân bệnh thận mạn?
Lợi tiểu quai được khuyến cáo sử dụng cho bệnh nhân bệnh thận mạn giai đoạn 4 – 5 (MLCT < 30 ml/ph) và được chứng minh là có hiệu quả làm giảm thể tích dịch ngoại bào ở bệnh nhân có mức lọc cầu thận giảm nặng. Tuy nhiên hiệu quả lâu dài của lợi tiểu quai lên lợi ích tim mạch chưa được chứng minh.
Furosemide 40mg
Một vài chú ý khi dùng lợi tiểu quai, lợi thiểu thiazid
Các thuốc lợi tiểu thiazid (clorothalidon, hydroclorothiazid) và thuốc lợi tiểu quai (bumetanid, furosemid, torsemid) đều làm tăng acid uric máu (lợi tiểu). Sự tăng đào thải dịch có thể dẫn đến sự mất cân bằng điện giải.
Bệnh nhân cần được theo dõi điện giải đồ để phát hiện các rối loạn điện giải như tăng kali máu hay hạ magie máu.
Hiện tượng tụt huyết áp tư thế đứng có thể xảy ra đối với bất kỳ một thuốc điều trị tăng huyết áp nào. Tuy nhiên, hiện tượng này rất phổ biến đối với các thuốc lợi tiểu. Cần dặn dò bệnh nhân khi bắt đầu điều trị bằng các thuốc lợi tiểu cần phải chuyển từ tư thế ngồi hoặc tư thế nằm sang tư thế đứng một cách từ từ.
Mặc dù theo lý thuyết bạn cũng biết lợi tiểu quai hay Thiazide đều làm hạ Kali máu nhưng với một bệnh nhân STM thì Kali máu có thể tăng cao dù điều trị lợi tiểu => theo dõi ĐGĐ là quan trọng.
Tại sao dùng lợi tiểu quai và thiazide có thể làm tăng acid uric máu?
Theo kết quả nghiên cứu của tiến sĩ Mara A. McAdams DeMarco, đại học Johns Hopkins, Hoa Kỳ đã cho thấy những người sử dụng thuốc lợi tiểu để điều trị tăng huyết áp có nguy cơ bị tấn công bởi các cơn gút cấp tăng gấp 1.48 lần và nguy cơ này càng cao nếu sử dụng kéo dài.
Nguyên nhân được các nhà khoa học lý giải là do chúng gây thúc đẩy sự tái hấp thu acid uric ở ống thận, ức chế sự bài tiết acid uric và dẫn đến làm tăng nồng độ chất này trong cơ thể.
Chỉ duy nhất thuốc lợi tiểu nhóm spironolactone là không ảnh hưởng đến quá trình thải trừ acid uric, nên bệnh nhân gút hoặc người mắc tình trạng tăng acid uric máu không triệu chứng có thể dùng kéo dài; còn hầu hết các thuốc còn lại đều phải thận trọng trước khi sử dụng.
Tại sao lại không dùng lợi tiểu kháng aldosteron ở bệnh nhân STM?
Bởi vì các thuốc kháng aldosteron là các thuốc lợi tiểu giữ kali nên làm tăng nguy cơ tăng kali máu, đặc biệt khi sử dụng với các thuốc ức chế men chuyển hoặc các thuốc ức chế thụ thể AT1.
Aldosteron gây ảnh hưởng nguy hiểm đến tiến triển của bệnh thận mạn.
Hậu quả của tăng kali máu bao gồm loạn nhịp tim và yếu cơ nghiêm trọng.
Sử dụng kháng Aldosteron khác nào thêm dầu vào lửa.
Vậy thì khi nào sử dụng kháng aldosteron để hạ huyết áp ở bệnh nhân STM?
Thuốc kháng thụ thể aldosteron (như spironolacton, triamteren) có thể được sử dụng trong điều trị bệnh thận mạn nếu sử dụng các thuốc lựa chọn đầu tay và lựa chọn hàng thứ 2 mà vẫn chưa đạt được mức huyết áp mục tiêu.
Thử nghiệm lâm sàng cho thấy các thuốc này cho tác dụng làm giảm protein niệu khi kết hợp với một thuốc ức chế men chuyển hay một thuốc ức chế thụ thể AT1.
Các bệnh nhân sử dụng thuốc lợi tiểu giữ kali cần được kiểm tra nồng độ kali thường xuyên để kịp thời phát hiện tình trạng rối loạn điện giải.
Tuy nhiên, lâm sàng lại ít khi phải dùng đến kháng aldosteron để điều trị STM.
Vai trò của thuốc chẹn kênh calci trong điều trị THA ở bệnh nhân STM
Các thuốc chẹn kênh calci là sự lựa chọn thứ 2 hoặc thứ 3 trong điều trị tăng huyết áp ở bệnh nhân mắc bệnh thận mạn.
Trong khi không có nhiều sự khác biệt về tác dụng hạ huyết áp giữa các thuốc chẹn kênh calci không thuộc nhóm dihydropyridin (diltiazem, verapamil) và thuộc nhóm dihydropyridin (amlodipin, nifedipin), các thuốc không thuộc nhóm dihydropiridin lại có tác dụng làm giảm đáng kể protein niệu kể cả khi sử dụng đơn độc hay dùng đồng thời với một thuốc ức chế men chuyển hoặc một thuốc ức chế thụ thể AT1.
Với khả năng làm giảm protein cùng tác dụng hạ huyết áp, các thuốc chẹn kênh calci không thuộc nhóm dihydropyridin được khuyến cáo là lựa chọn thứ 2 hoặc thứ 3 trong điều trị ở các bệnh nhân mắc bệnh thận mạn có kèm hoặc không kèm đái tháo đường và có protein niệu.
Các thuốc chẹn kênh calci nhóm nondihydropyridin có thể là lựa chọn thứ 2 đối với các bệnh nhân bệnh thận mạn không mắc đái tháo đường và không có protein niệu.
Tác dụng phụ hay gặp của chẹn calci?
Các tác dụng không mong muốn thường gặp bao gồm phù và táo bón khi sử dụng các thuốc không thuộc nhóm dihydropyridin (đặc biệt là verapamil) và hiện tượng đỏ bừng mặt và phù ngoại biên đối với thuốc nhóm dihydropyridin.
Tại sao chẹn calci gây táo bón?
Trong bài hội chứng ruột kích thích tôi đã giải thích vấn đề này.
Tại sao chẹn calci gây phù ngoại biên (hay gặp là phù mắt cá chân)?
Phù ngoại biên trong chẹn calci không như phù thận hay phù do suy tim. Phù ở đây không phải do ứ dịch, mà là do tái phân bố lại dịch ngoại bào.
Cơ chế:
Phù ngoại biên liên quan đến sự giảm sức cản của các tiểu động mạch không tương xứng với tuần hoàn tĩnh mạch. Sự thay đổi này làm tăng áp suất thủy tĩnh trong tuần hoàn tiền mao mạch và đẩy dịch vào khoang kẽ.

Phù mắt cá chân do dùng Amlodipine

Một bệnh nhân bị phù nề bàn chân / mắt cá chân do Cilnidipine rất hiếm gặp (Cilnidipine là thuốc chẹn kênh canxi dihydropyridine thế hệ thứ 4 dùng thay thế cho bệnh nhân tăng huyết áp bị phù mắt cá chân do amlodipne)
Với các nhóm thuốc làm hạ huyết áp khác ít được dùng trên đối tượng bệnh nhân STM nên tôi không đề cập đến.
Tóm lại: trong phần điều trị THA, tôi muốn bạn nhớ để ý đến nhóm ACEI/Chẹn thụ thể và Lợi tiểu quai/Thiazide nhiều hơn.
Bạn cũng nên biết thêm: THA + ĐTĐ +BTM là tam tấu hay đi cùng nhau.

Một vài khuyến cáo về điều trị THA ở bệnh nhân BTM của KDIGO 2012
Bạn có thể tham khảo.
Điều trị tăng huyết áp ở bệnh nhân bệnh thận mạn không ĐTĐ chưa lọc máu
– Khuyến cáo đối với người lớn bệnh thận mạn không ĐTĐ chưa lọc máu và albumin niệu < 30 mg/24 giờ (hoặc tương đương*) có huyết áp tâm thu > 140 mmHg hoặc huyết áp tâm trương > 90 mmHg được điều trị bằng thuốc hạ áp để duy trì huyết áp tâm thu ≤ 140 mmHg và huyết áp tâm trương ≤ 90 mmHg. (1B).
– Khuyến cáo đối với người lớn bệnh thận mạn không ĐTĐ chưa lọc máu và albumin niệu từ 30 đến 300 mg/24 giờ (hoặc tương đương*) có huyết áp tâm thu > 130 mmHg hoặc huyết áp tâm trương > 80 mmHg được điều trị bằng thuốc hạ áp để duy trì huyết áp tâm thu ≤ 130 mmHg và huyết áp tâm trương ≤ 80 mmHg. (2D)
– Khuyến cáo đối với người lớn bệnh thận mạn không ĐTĐ chưa lọc máu và albumin niệu > 300 mg /24 giờ (hoặc tương đương*) có huyết áp tâm thu > 130 mmHg hoặc huyết áp tâm trương > 80 mmHg được điều trị bằng thuốc hạ áp để duy trì huyết áp tâm thu ≤ 130 mmHg và huyết áp tâm trương ≤ 80 mmHg. (2C)
– Khuyến cáo sử dụng ARB hoặc ACEI để điều trị tăng huyết áp khi có chỉ định cho bệnh nhân là người lớn bệnh thận mạn không ĐTĐ chưa lọc máu và albumin niệu 30 đến 300 mg/24 giờ (hoặc tương đương*). (2D)
– Khuyến cáo sử dụng ARB hoặc ACEI để điều trị tăng huyết áp khi có chỉ định cho bệnh nhân là người lớn bệnh thận mạn không ĐTĐ chưa lọc máu và albumin niệu > 300 mg/24 giờ (hoặc tương đương*). (1B)
Điều trị tăng huyết áp ở bệnh nhân bệnh thận mạn ĐTĐ chưa lọc máu
– Khuyến cáo người lớn ĐTĐ và bệnh thận mạn chưa lọc máu với albumin niệu < 30 mg / 24 giờ (hoặc tương đương*) có huyết áp tâm thu > 140 mmHg hoặc huyết áp tâm trương > 90 mmHg được điều trị bằng thuốc hạ áp để duy trì huyết áp tâm thu ≤ 140 mmHg và huyết áp tâm trương ≤ 90 mmHg. (1B)
– Khuyến cáo người lớn ĐTĐ và bệnh thận mạn chưa lọc máu với albumin niệu > 30 mg/ 24 giờ (hoặc tương đương*) có huyết áp tâm thu > 130 mmHg hoặc huyết áp tâm trương > 80 mmHg được điều trị bằng thuốc hạ áp để duy trì huyết áp tâm thu ≤ 130 mmHg và huyết áp tâm trương ≤ 80 mmHg. (2D)
– Khuyến cáo sử dụng ARB hoặc ACEI ở bệnh nhân là người lớn ĐTĐ và bệnh thận mạn chưa lọc máu với albumin niệu 30 đến 300 mg/24 giờ (hoặc tương đương*). (2D)
– Khuyến cáo sử dụng ARB hoặc ACEI ở bệnh nhân là người lớn ĐTĐ và bệnh thận mạn chưa lọc máu với albumin niệu > 300 mg/24 giờ (hoặc tương đương*). (1B)
Điều trị tăng huyết áp ở bệnh nhân thận ghép
– Khuyến cáo ở người lớn thận ghép huyết áp tâm thu > 130 mmHg hoặc huyết áp tâm trương > 80 mmHg được điều trị để duy trì để duy trì huyết áp tâm thu ≤ 130 mmHg và huyết áp tâm trương ≤ 80 mmHg, không phân biệt mức albumin niệu. (2D)
– Ở người lớn thận ghép, lựa chọn thuốc hạ áp sau khi xem xét thời gian sau lọc máu, sử dụng ức chế calcineurin, sự hiện diện hoặc không hiện diện của albumin niệu dai dẳng và các yếu tố khác. (Không phân loại)
Điều trị tăng huyết áp ở người lớn tuổi bị bệnh thận mạn chưa lọc máu
Kiểm soát huyết áp tốt (<130/80 mmHg) góp phần hạn chế tiến triển BTM. Trên thực tế lâm sàng, tùy từng bệnh nhân cụ thể mà chúng ta có mục tiêu huyết áp khác nhau (cá nhân hóa).
Ví dụ: trong trường bệnh nhân có protein niệu nhiều thì mục tiêu huyết áp có thể thấp hơn (125/80 mmHg), trong trường hợp bệnh nhân chạy thận nhân tạo thì mục tiêu huyết áp cao hơn (135/80 mmHg).
Điều trị thiếu máu ở bệnh nhân BTM
Tại sao cần phải điều trị thiếu máu ở bệnh nhân STM?
Bởi vì thiếu máu gây tăng tỷ lệ tử vong, tăng phì đại thất trái và suy tim xung huyết, tăng tốc độ tiến triển đến suy thận giai đoạn cuối. Kết quả một nghiên cứu cho thấy, nguy cơ tử vong tăng lên 3 lần với mỗi 10g/l Hb giảm đi (trong khoảng 90-130g/l).
Cơ chế gây thiếu máu trong STM?
Tôi đã bàn luận về phần trên.
Cơ chế chính gây thiếu máu trong STM là gì?
Cơ chế chủ yếu là thiếu Erythropoietin (EPO)
Bình thường, nồng độ Erythropoietin (EPO) từ 3 – 30 mU/ml, tăng lên 100 lần khi Hb giảm xuống. Mối liên quan nghịch này giảm hoặc mất đi khi mức lọc cầu thận <30 – 40 ml/p.
Một số cơ chế gây ra tình trạng thiếu EPO tương đối
(1): Thích nghi của thận giảm làm giảm tiêu thụ oxy, cải thiện sự oxy hóa ở phần tủy thận ngoài, giảm kích thích sản xuất EPO;
(2): EPO được trung hòa bởi các receptor EPO hòa tan (tăng sản xuất khi có mặt các chất trung gian)
(3): EPO bị bất hoạt bởi các proteinase (hoạt động tăng lên trong môi trường urê máu cao) (4): thậm chí nếu EPO với một lượng đầy đủ đến được một tủy xương nguyên vẹn, hoạt động của nó vẫn có thể bị suy yếu bởi sự vắng mặt của các yếu tố cho phép (IL-3, calcitriol,..) và sự có mặt của các yếu tố ngăn cản (PTH..).
Thuốc chủ đạo trong điều trị thiếu máu ở bệnh nhân BTM là gì?
Đó là Erythropoietin.

Recormon – Erythropoietin người tái tổ hợp
Khi nào có chỉ định điều trị EPO?
Có chỉ định điều trị thiếu máu ở người lớn khi nồng độ Hb <10 g/dL.
Vì sao không có biệt dược EPO đường uống?
Bởi vì EPO có bản chất là protein nên khi dùng đường tiêu hóa thì sẽ bị phân hủy và không còn tác dụng nữa.
Mục tiêu điều trị, mức Hb cần nâng lên bao nhiêu?
– Duy trì Hb 11g/dL – 12g/dL (Hct 33% – 36%) đạt được trong vòng 4 tháng kể từ khi bắt đầu điều trị bằng EPO (Erythropoietin người tái tổ hợp).
– Hb mục tiêu trên đây không áp dụng cho liệu pháp truyền máu.
Ở bệnh nhân lọc máu, mức Hb mục tiêu là bao nhiêu?
Ở bệnh nhân lọc máu, nồng độ Hb mục tiêu là 10 đến 11,5 g/dL. Tuy nhiên con số này phải cá nhân hóa trên bệnh nhân cụ thể.
Đánh giá một số yếu tố ảnh hưởng đến thiếu máu ở người bệnh suy thận mạn
– Cần đánh giá tình trạng dự trữ sắt thường xuyên để bổ xung sắt đầy đủ (đường tĩnh mạch hoặc đường uống) cho đến khi đặt mức Hb mục tiêu. Lưu ý cần ngừng truyền sắt tĩnh mạch 1 tuần trước khi xét nghiệm tình trạng sắt.
– Đánh giá số lượng hồng cầu lưới
– Đánh giá tình trạng viêm
– Đánh giá tình trạng dinh dưỡng
– Đánh giá tình trạng lọc máu đầy đủ
– Đánh giá tình trạng mất máu mạn tính
Khuyến cáo liều bắt đầu của ESAs trong CKD
| ESA | CKD có lọc máu | CKD không lọc máu |
| Epoetin alfa | 50-100 U/kg, chia 3 lần/ tuần | 50-100 U/kg mỗi 1-2 tuần |
| Darbepoetin alfa | 0.45 μg/kg mỗi tuần | 0.45 μg/kg mỗi 2-4 tuần |
| Methoxy polyethylene glycol-epoetin beta | 0.6 μg/kg, mỗi 2 tuần | 0.6 μg/kg mỗi 2-4 tuần |
Trong BTM tại sao lại cần bổ sung sắt?
Bổ sung sắt luôn được nhấn mạnh như là một trong những điểm mấu chốt của điều trị thiếu máu ở người bệnh CKD.
Hơn nữa, bổ sung sắt có thể có những lợi ích ngoài khía cạnh huyết học, bao gồm cải thiện các chức năng nhận thức, miễn dịch, điều nhiệt, thích nghi với luyện tập thể lực.

Thực phẩm chứa nhiều sắt
Có mấy chế phẩm sắt?
2 loại đó là sắt uống và sắt tĩnh mạch.
Tại sao sắt uống lại được dùng nhiều trên lâm sàng?
Mặc dù sắt uống đáp ứng hơn kém hơn sắt tĩnh mạch. Tuy vậy, do giá thành thấp và dễ sử dụng, sắt uống vẫn được sử dụng trước sắt tĩnh mạch.
Đáp ứng kém được cho là (1): mất một lượng sắt qua thận nhân tạo trong khi sắt hấp thu qua ruột không kịp bù, (2) sự kết hợp tối đa của sắt và tế bào hồng cầu xảy ra muộn (33 ngày so với 8,6 ngày nếu tiêm tĩnh mạch); (3): nồng độ hepcidin (tăng lên trong suy thận) cao gây ức chế hấp thu sắt uống từ tá tràng.
Ở bài viết này tôi chỉ cung cấp cho bạn những kiến thức cần nhớ chứ không đi sâu vào liều lượng, cách dùng, theo dõi sắt hay EPO, hay các thuốc điều trị THA ở bệnh nhân BTM.
Thật sai lầm khi bài viết này mà không nhắc đến điều trị hội chứng tăng urê máu. Tôi sẽ nhắc đến liệu pháp Keto acid.
Liệu pháp Keto acid
Đầu tiên, liệu pháp Keto acid là gì?
Liệu pháp Keto Acid là “chế độ ăn hạn chế đạm” và kết hợp với “Keto Acid.”
Tại sao lại phải hạn chế đạm ở bệnh nhân CKD?
Chế độ ăn hạn chế đạm sẽ giúp hạn chế chất thải chứa nitơ, phosphat… Do đó sẽ giảm quá tải lọc cho thận và làm dịu nhẹ hội chứng tăng urê huyết => bệnh nhân có chất lượng cuộc sống tốt hơn.
Hạn chế đạm cụ thể là như nào?
Có 2 chế độ ăn hạn chế đạm trong bệnh thận mạn, đó là ăn giảm đạm Low Protein Diet (LPD), với mức protein nhập là 0.6g protein/kg/ngày.
Chế độ ăn thứ hai là chế đô ăn rất giảm đạm Very Low Protein Diet (VLPD) với mức protein nhập là 0,3 – 0,4g protein/kg/ngày
Nên khuyên bệnh nhân dùng đạm thực vật:
+ Năng lượng nên được bổ sung từ các loại tinh bột chứa ít đạm hoặc dầu thực vật, đường, mật… Tinh bột chứa ít đạm như bột sắn dây, miến dong, khoai lang, khoai tây,…
+ Nên hạn chế lượng cơm ăn vào vì cơm chứa rất nhiều đạm.
+ Mỗi ngày bệnh nhân chỉ nên ăn 1 chén cơm và ăn độn thêm các loại tinh bột chứa ít đạm nêu trên.
Một chén cơm xới ngang miệng chén chứa đến 7g đạm. Một bệnh nhân 50kg áp dụng chế độ ăn VLPD 0,3g protein/kg/ngày thì lượng đạm được phép nhập cho bệnh nhân này là 15g/ngày. Nếu người này ăn mỗi ngày 3 chén cơm thì lượng đạm nhập đã lên đến 21g/ngày, vượt xa mức 15g/ngày. Do vậy, cần phải hạn chế lượng cơm ăn vào. Mỗi ngày bệnh nhân này chỉ nên ăn 1 chén cơm, và ăn độn thêm các loại tinh bột chứa ít đạm nêu trên. Chế độ ăn hạn chế đạm sẽ giúp hạn chế chất thải chứa nitơ, urê, phosphat… và do đó sẽ giảm độc quá tải lọc cho thận.
Trên thực tế, rất nhiều bạn không chịu tìm hiểu về chế độ ăn BTM, nhưng đây là điều rất quan trọng. Tuy nhiên, nhiều bệnh nhân BTM bị suy dinh dưỡng mà hạn chế đạm thì thể trạng bệnh nhân lại tiếp tục yếu đi. Do đó PHẢI CÂN NHẮC giữa lợi và hại và keto acid sinh ra để giải quyết được điều đó.
Những điều cần biết về Keto acid
Keto acid là Ketoanalogue, là thành phần của viên Ketosteril (Fresenius Kabi, Đức). Ketosteril được thế giới sử dụng từ năm 1982.
Ở khoa thận tiết niệu có chế phẩm Ketovital.

Keto Acid là tiền chất không chứa Nitơ của Acid Amin, không chứa gốc amin -NH2. Do vậy, Keto Acid sẽ không tạo ra chất thải chứa Nitơ, không tạo ra urê và lấy đi gốc amin trong máu để chuyển ngược lại thành một Acid Amin nhờ phản ứng chuyển amin, điều này sẽ giúp giảm quá tải chất thải chứa nitơ trong máu, giảm urê huyết, giảm các biến chứng của ngộ độc urê huyết, giảm creatinin huyết và giảm tải cho thận.
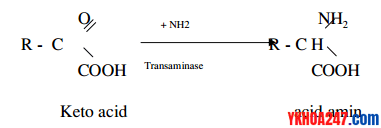
Acid Amin được tạo ra từ Keto Acid sẽ giúp bù đắp lượng đạm thiếu hụt cho cơ thể do bệnh nhân phải ăn hạn chế đạm. Do vậy, dù cho bệnh nhân phải ăn giảm đạm rất khắt khe nhưng cơ thể vẫn không thiếu đạm. Bệnh nhân không bị suy dinh dưỡng đạm nếu tuân thủ tốt chế độ ăn giảm đạm và uống đủ liều Ketosteril.
Các Keto Acid ở dưới dạng muối calci, mỗi viên Ketosteril có chứa 50mg calci, calci sẽ đóng vai trò là một chất gắn kết phosphat, làm giảm phosphate huyết và góp phần cải thiện chứng loạn dưỡng xương do thận. Liều dùng được khuyến cáo là 1 viên/5kg cân nặng/ngày, chia làm 3 lần trong ngày, uống trong lúc ăn. Chế độ ăn hạn chế đạm kết hợp Ketoanalogue chỉ cung cấp từ 7-9mg phosphate/kg/ngày, do đó giúp tránh được những biến chứng của vấn đề tăng phosphate huyết như cường cận giáp, loãng xương, ngứa, tăng tiến triển suy thận…
Hiệu quả của Liệu pháp Keto acid như thế nào?
Tác động của Liệu pháp Keto Acid là giúp bảo tồn chức năng thận, bảo vệ những nephron còn lại, bảo tồn chức năng thận tồn lưu, bảo vệ chức năng thận còn lại, do đó sẽ giúp cải thiện và duy trì vai trò của thận trong cơ thể như vai trò tổng hợp các nội tiết tố Erythropoietin giúp tăng tạo hồng cầu, tổng hợp vitamin D giúp tránh loãng xương, cho phép bệnh nhân uống được nhiều nước hơn, lượng nước tiểu tiểu ra nhiều hơn…, những tác động này đã lý giải tại sao liệu pháp Keto Acid trong nhiều nghiên cứu đã cho thấy lợi ích giúp tăng tạo hồng cầu và giảm liều Erythropoietin, giảm liều các thuốc điều trị gút như Allopurinol, giảm liều các thuốc lợi tiểu, thuốc huyết áp…
Liệu pháp Keto Acid làm giảm protein niệu.
Tại sao Liệu pháp Keto Acid lại làm giảm protein niệu?
Nếu protein nhập cao sẽ làm gia tăng đạm niệu, trong khi hạn chế đạm nhập sẽ làm giảm đạm niệu. Hiệu quả của chế độ ăn hạn chế đạm kết hợp với Keto Acid trong điều trị đạm niệu đã được chứng minh.
Điều trị tăng Kali máu ở bệnh nhân BTM
Tại sao lại phải điều trị tăng kali máu?
Vì Kali máu cao dẫn đến nhiều biến chứng nguy hiểm. Điển hình là biến chứng tim mạch, rung thất, ngưng tim.
Cách nhanh nhất để phát hiện tăng Kali máu?
Lâm sàng có đúng không? Không! Lâm sàng chỉ giúp gợi ý, để lâm sàng xảy ra thì bệnh nhân đã nặng rồi. Cách tốt nhất là làm ĐGĐ.
Các cách điều trị tăng Kali máu?
Có 2 cách chính đó cũng chính là cơ chế: Vận chuyển kali vào trong tế bào và Thải kali khỏi cơ thể.
Các cách dùng trên lâm sàng để đem kali vào trong tế bào
– Insulin pha glucose truyền TM:
+ Chỉ định khi tăng kali máu nặng (K+ ≥ 6,5 mmol/L) cũng có thể chỉ định khi tăng kali máu mức độ trung bình (K + = 6,0 – 6,4 mmol/L)
+ Pha 10 đơn vị insulin trong dung dịch glucose (25 g glucose: 125 mL đường 20%) truyền TM trong 15 – 30 phút
+ Tác dụng sau 15 phút, đạt đỉnh sau 60 phút, kéo dài trong 2 – 3 giờ
+ Chú ý nguy cơ hạ đường máu => TD đường máu
– Khí dung salbutamol:
+ Chỉ định khi tăng kali máu nặng (K+ ≥ 6,5 mmol/L), cũng có thể chỉ định khi tăng kali máu mức độ trung bình (K+ = 6,0 – 6,4 mmol/L)
+ Khí dung 10 – 20 mg salbutamol
+ Bắt đầu tác dụng sau 30 phút, kéo dài 2 – 3 giờ
+ Không dùng salbutamol đơn trị liệu trong điều trị tăng kali máu nặng
+ Thận trọng: BN có bệnh tim (do thuốc gây tăng nhịp tim)
– Dung dịch kiềm:
+ Chỉ dùng khi nhiễm toan chuyển hóa nặng gây tăng kali máu
+ Tăng kali máu nặng: natribicarbonat 8,4% (1 mmol/mL) 1 – 3 ml TM trong 5 phút
+ Tăng kali máu trung bình: natribicarbonat 8,4% (1 mmol/mL) 1 ml truyền TM trong 30 phút
+ Bắt đầu tác dụng: 30 – 60 phút, kéo dài 2 – 3 giờ
Các cách thải kali khỏi cơ thể
– Thuốc lợi tiểu quai: dùng furosemid sớm, duy trì lượng nước tiểu thỏa đáng.
– Nhựa trao đổi ion:
+ Chỉ định trong điều trị tăng kali máu mức độ trung bình và nhẹ
+ Kayexalat 15 g x 4 lần/ngày, uống hoặc thụt trực tràng 30g x 2 lần/ngày
+ Bắt đầu tác dụng sau 1 giờ (thụt), đến 6 giờ (uống), tác dụng rõ trong vòng 1 – 5 ngày
+ Có thể có các tác dụng không mong muốn trên hệ tiêu hóa hoặc tăng Na máu
– Lọc máu ngoài thận: Biện pháp hiệu quả nhất loại bỏ kali và điều chỉnh các RL khác
Trên lâm sàng hay dùng Insullin TM và Furosemide hơn. Trong phạm vi bài này tôi chỉ nói đến đó.
Một số điều trị về các khía cạnh khác tôi không bàn đến. Điều đó phụ thuộc từng đối tượng cụ thể như bệnh nhân có tăng lipid máu, có tăng acid uric…. (Bạn có thể tham khảo những bài viết liên quan đến chủ đề đó).
Điều trị bệnh thận mạn giai đoạn cuối
Tại sao lại phải điều trị thay thế thận?
Bởi vì khi người bệnh STM ở giai đoạn cuối điều trị nội khoa không còn tác dụng nữa. Hội chứng urê huyết cao, Kali máu tăng… rất nguy hiểm, đe dọa tính mạng và giảm chất lượng cuộc sống => bắt buộc phải điều trị thay thế thận.
Các chỉ định điều trị thay thế thận?
Trừ khi người bệnh từ chối, mọi người bệnh BTM giai đoạn cuối, với lâm sàng của hội chứng urê huyết cao (thường xảy ra khi độ thanh thải creatinin dưới 15 ml/phút hoặc sớm hơn ở người bệnh đái tháo đường) đều có chỉ định điều trị thay thế thận.
Các chỉ định điều trị thay thế thận:
– Tăng kali máu không đáp ứng với điều trị nội khoa
– Toan chuyển hóa nặng (khi việc dùng HCO3 có thể sẽ gây quá tải tuần hoàn).
– Quá tải tuẩn hoàn, phù phổi cấp không đáp ứng với điều trị lợi tiểu.
– Suy dinh dưỡng tiến triển không đáp ứng với can thiệp khẩu phần
– Mức lọc cầu thận từ 5-10ml/ph/1,73 m2 (hoặc BUN > 100mg/dL, creatinine huyết thanh > 10mg/dL)
Có mấy hình thức điều trị thay thế thận để bệnh nhân lựa chọn?
Có 3 hình thức điều trị thay thế thận bao gồm:
(1) Thận nhân tạo (hoặc thẩm tách máu, hemodialysis, HD)
(2) Thẩm phân phúc mạc (peritoneal dialysis, PD)
(3) Ghép thận. (Kidney transplantation)
Có thể lựa chọn một trong ba phương pháp, tuỳ vào từng trường hợp cụ thể của người bệnh.
Điều trị thay thế thận (Renal Replacement Therapy): Thận nhân tạo (Hemodialysis) vs Lọc màng bụng (Peritoneal Dialysis), Animation
Một vài chống chỉ định của từng phương pháp thay thế thận
| Tuyệt đối | Tương đối | |
| Thận nhân tạo (HD) | Không có đường lấy máu thích hợp | + Sợ kim chích
+ Suy tim + Rối loạn đông máu |
| Thẩm phân phúc mạc (PD) | + Mất hoàn toàn chức năng của màng bụng.
+ Sẹo dính trong phúc mạc làm ngăn cản dịch lọc dẫn lưu. + Dịch lọc dò lên cơ hoành. + Không có người giúp thay dịch lọc. |
+ Mới mổ ghép động mạch chủ bụng.
+ Có shunt não thất – ổ bụng (trong não úng thủy). + Không dung nạp với chứa dịch trong ổ bụng. + Suy dinh dưỡng nặng. + Nhiễm trùng da. + Bệnh đường ruột (viêm ruột, viêm túi thừa). + Béo phì. |
| Ghép thận | Không có chống chỉ định tuyệt đối | + Người nhận có nguy cơ thải ghép cao: phản ứng đọ chéo (cross-match) người nhận-người cho dương tính
+ Sức khỏe người nhận không cho phép thực hiện cuộc mổ. + Nhiễm cytomegalovirus (CMV), viêm gan virus C, nhiễm khuẩn đường mật, lao… + Bệnh nhân ung thư giai đoạn cuối, xơ gan mất bù, suy tim nặng… |
Hiểu về lọc màng bụng (thẩm phân phúc mạc)
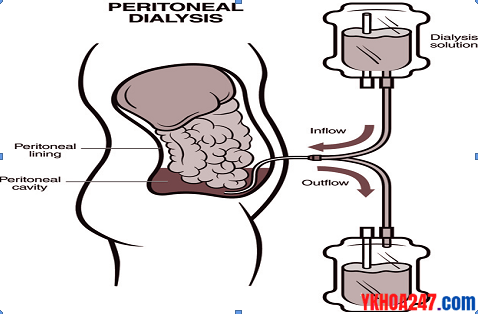
Lọc màng bụng (Peritoneal Dialysis)
Lọc màng bụng là phương pháp lọc máu có sử dụng màng bụng của chính người bệnh như một màng lọc bán thấm để đào thải một số sản phẩm của quá trình chuyển hóa các chất, trong đó có urê, creatinin và một số chất điện giải ra ngoài cơ thể.
Màng bụng có thể giúp lọc máu do màng bụng có tính chất là một màng bán thấm, cho phép các chất hoàn tan có nồng độ lớn và nước thừa trong máu xuyên qua màng bụng và vào khoang dịch lọc.
Để thực hiện chức năng này, một ống thông catheter sẽ được phẫu thuật đưa vào khoang phúc mạc người bệnh. Catheter này giúp đưa dịch lọc vào ổ bụng và tháo dịch ra sau khi đã lọc xong.
Kể từ năm 1976, LMB trong đó chủ yếu là lọc màng bụng liên tục ngoại trú đã trở thành phương thức lọc máu hiệu quả, chiếm 10-15% tổng số lọc máu và là phương pháp lọc máu tại nhà chủ yếu trên toàn cầu.
Nguyên tắc của lọc màng bụng?
Lọc màng bụng là sự trao đổi chất giữa máu của mao mạch màng bụng và dịch lọc trong khoang màng bụng, sự trao đổi này diễn ra qua màng bụng. Các chất tan chuyển động theo các quy luật vật lý: khuếch tán và đối lưu; trong khi nước chuyển động dựa vào chênh lệch áp lực thẩm thấu – được tạo ra bởi các chất thẩm thấu trong dịch lọc.
Chỉ định và chống chỉ định của lọc màng bụng
Tham khảo bảng trên.
Ưu điểm của lọc màng bụng so với thận nhân tạo?
Lọc màng bụng thuận tiện cho bệnh nhân, vì người bệnh có thể thực hiện tại nhà, một tháng người bệnh chỉ cần đến bệnh viện một lần để bác sĩ khám, kiểm tra và nhận dịch lọc để thực hiện trong tháng tiếp theo.
Lọc màng bụng đặc biệt phù hợp với những bệnh nhân ở vùng sâu, vùng xa, bệnh nhân không thể tiếp cận được với máy chạy thận nhân tạo hoặc để được chạy thận, người bệnh phải vượt qua một quãng đường di chuyển rất dài.
Những bệnh nên được chờ ghép thận hoặc vẫn tiểu được thì lọc màng bụng có ưu điểm hơn.
Biến chứng hay gặp phải khi lọc màng bụng
Trong quá trình lọc màng bụng suy thận, nếu không tuân thủ các kỹ thuật được hướng dẫn và đảm bảo vệ sinh, bệnh nhân rất dễ bị nhiễm trùng, đặc biệt là nhiễm trùng phúc mạc, nhiễm trùng chân ống catheter. Các biến chứng khác người bệnh có thể gặp là tăng đường huyết, rối loạn lipid máu, tràn dịch màng phổi,…
Vì sao không nên để bệnh nhân bị nhiễm trùng màng bụng?
Bởi vì có 2 lý do chủ yếu sau đây:
+ Làm tăng tỉ lệ tử vong do nhiễm trùng.
+ Làm tổn thương và gây xơ hóa màng bụng, làm giảm trao đổi chất qua màng bụng. Từ đó làm giảm hiệu quả của phương pháp lọc màng bụng.
Cách nhận biết sớm nhất nhiễm trùng màng bụng?
Về các dấu hiệu nhận biết gồm có: dấu nhiễm trùng, đau bụng, thay đổi tính chất của dịch lọc. Trong đó, dịch lọc thường đục trước khi bệnh nhân có các biểu hiện đau bụng và dấu nhiễm trùng.
Cho nên cần phải giáo dục cho bệnh nhân biết được sự thay đổi của dịch lọc để có thể nhập viện kịp thời. Cụ thể là hướng dẫn cho bệnh nhân bằng cách đọc các chữ phía sau xuyên qua lớp dịch trong túi đựng dịch. Khi không còn đọc được dòng chữ phía sau nữa thì có nghĩa là đang bị nhiễm trùng màng bụng.
Các mục đích của lọc màng bụng
Có 2 mục đích chính của lọc màng bụng:
+ Thứ nhất là lấy các chất thải: sử dụng dung dịch lọc đẳng trương.
+ Thứ hai là lấy dịch dư thừa: sử dung dịch lọc ưu trương thường là đường.
Có mấy phương pháp lọc màng bụng?
– Lọc màng bụng cấp.
– Lọc màng bụng liên tục ngoại trú (CAPD) => bệnh nhân tự thực hiện ở nhà sau khi nhận được tư vấn của bác sĩ.
– Lọc màng bụng chu kỳ tự động (ADP) (lọc bằng máy).
Khi nào thì dùng lọc màng bụng cấp?
Lọc màng bụng cấp được chỉ định trong suy thận cấp hoặc các đợt tiến triển nặng của suy thận mạn, khi pH máu ≥ 7,2, Kali máu ≥ 6,5 mmol/l, urê máu ≥ 30 mmol/l, cùng với quá tải thể tích tuần hoàn đe dọa phù phổi cấp,…
Có thể thay thế bằng chạy thận nhân tạo nếu bệnh nhân có cầu tay.
Hiểu về lọc màng bụng liên tục ngoại trú (CAPD)
Một ống thông cố định được luồn qua một đường dưới da thành bụng vào khoang bụng tới vị trí sát túi cùng Douglas. Ống thông thường dùng là catheter Tenckhoff có hai nút chặn. Đặt ống thông được tiến hành trong phòng mổ và cố định trong suốt thời gian bệnh nhân lọc màng bụng.
Trong lọc màng bụng liên tục ngoại trú, dịch lọc luôn hiện diện trong khoang bụng của người bệnh. Dịch được thay khoảng 4 lần trong ngày, quá trình thay và tháo dịch được thực hiện bằng tay, có thể thực hiện tại nhà. Các giai đoạn trao đổi dịch diễn ra như sau:
+ Giai đoạn 1: đưa dịch vào. Dịch chưa lọc vô trùng được cho vào ổ bụng qua catheter.
+ Giai đoạn 2: ngâm dịch. Dịch lọc được ngâm trong ổ bụng từ 4-8 giờ tùy theo nồng độ dịch.
+ Giai đoạn 3: xả dịch ra. Dịch đã ngâm được xả ra ngoài dưới tác dụng của trọng lực. Sau khi xả hết dịch đã ngâm, bắt đầu đưa dịch vào như giai đoạn 1.
Đây là hình thức hay áp dụng trên lâm sàng, bệnh nhân tự làm ở nhà.
Người bệnh có thể chuyển đổi giữa lọc màng bụng và chạy thận nhân tạo không?
Hai phương pháp lọc màng bụng và chạy thận nhân tạo có thể hỗ trợ cho nhau trong quá trình điều trị cho bệnh nhân. Nếu bệnh nhân đã chạy thận nhân tạo lâu năm, mạch máu bị biến đổi, lòng mạch hẹp, lưu lượng máu giảm, việc lọc máu kém hiệu quả thì có thể xem xét chuyển qua lọc màng bụng.
Ngược lại, một bệnh nhân lọc màng bụng lâu năm nếu hiệu quả giảm có thể chuyển sang chạy thận nhân tạo. Ngay trong quá trình, bệnh nhân lọc màng bụng có thể hàng tháng đến bệnh viện chạy thận nhân tạo 1-2 lần để tăng cường hiệu quả việc lọc máu.
Chạy thận nhân tạo ở bệnh nhân STM
Chạy thận nhân tạo là phương pháp lọc máu ngoài cơ thể. Máu của người bệnh sẽ được dẫn vào hệ thống lọc của máy chạy thận nhân tạo. Máy sẽ giúp lọc bớt các chất độc và nước dư thừa. Sau khi lọc xong, máu sẽ được trả về vòng tuần hoàn người bệnh.
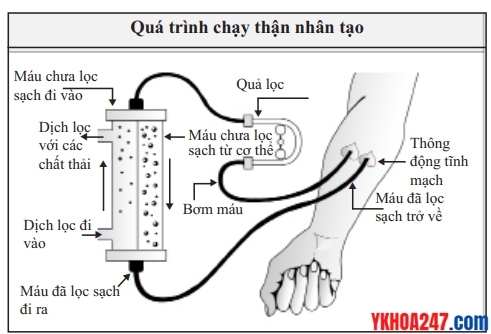
Cơ chế của chạy thận nhân tạo
Chạy thận nhân tạo dựa trên các cơ chế sau:
+ Cơ chế siêu lọc: Do áp lực của bơm máu cao hơn áp lực bơm dịch nên áp lực thủy tĩnh của khoang máu sẽ cao hơn áp lực ở khoang dịch, nước từ khoang máu sẽ di chuyển sang khoang dịch và kéo theo các chất hòa tan.
+ Cơ chế khuếch tán riêng phần: Các chất hòa tan như urê, creatinin và các chất có trọng lượng phân tử nhỏ khác có nồng độ cao trong máu sẽ khuếch tán từ máu sang khoang dịch lọc do sự chênh lệch nồng độ.
+ Cơ chế dòng đối lưu: Sau một thời gian khi chất tan ở khoang máu và khoang dịch lọc cân bằng nhau, quá trình khuếch tán sẽ giảm hiệu lực.
Bệnh nhân cần chuẩn bị gì trước khi chạy thận nhân tạo?
Đó là làm cầu nối AFV.
Cầu tay AFV là gì?
Cầu nối động – tĩnh mạch (AVF: Arteriovenous fistulation)
Lỗ rò động mạch (AV) là một kết nối bất thường giữa động mạch và tĩnh mạch. Thông thường, máu chảy từ động mạch đến mao mạch đến tĩnh mạch. Các chất dinh dưỡng và oxy trong máu đi từ mao mạch đến các mô trong cơ thể. Với một lỗ rò động mạch, máu chảy trực tiếp từ động mạch vào tĩnh mạch, bỏ qua một số mao mạch. Các lỗ rò động mạch thường được phẫu thuật tạo ra để sử dụng trong lọc máu ở những người bị bệnh thận nặng.

Cấu trúc cơ bản của cầu nối AVF?
Bao gồm:
+ Động mạch đến (inflow artery): phần động mạch trước miệng nối.
+ Động mạch đi (outflow artery): phần động mạch sau miệng nối
+ Miệng nối (anastomosis): vị trí tạo ra sự thông thương trực tiếp giữa động mạch và tĩnh mạch
+ Đoạn hiệu dụng (useable segment): đoạn tĩnh mạch sử dụng để cắm kim lọc máu
+ Tĩnh mạch dẫn lưu ngoại biên (outflow vein): phần tĩnh mạch dẫn lưu ngay sau đoạn hiệu dụng, có thể có một hoặc nhiều kênh dẫn lưu.
+ Tĩnh mạch dẫn lưu trung tâm (central venous return): phần tĩnh mạch dẫn lưu gần gốc chi, thường đề cập đến tĩnh mạch dưới đòn, tĩnh mạch cánh tay đầu, tĩnh mạch chủ trên.
Cần làm cầu nối AVF trước khi chạy thận trong thời gian bao lâu?
Khoảng 4 tuần (1 tháng) là cầu tay ổn định và hoạt động tốt => chạy thận nhân tạo.
Vì sao ưu tiên chọn vị trí làm cầu nối AVF ở vị trí xa tim trước?
Bởi vì khi làm cầu nối AVF càng gần tim thì bệnh nhân càng dễ bị suy tim do shunt động – tĩnh mạch, cơ chế cũng giống như các bệnh tim bẩm sinh có shunt trái phải.
Thời gian chạy thận thường là bao lâu?
Bệnh nhân sẽ chạy thận nhân tạo 3 ngày mỗi tuần, cách ngày, mỗi lần chạy thận kéo dài 3-4 giờ. Trong quá trình chạy thận, người bệnh có thể có các triệu chứng như nhìn mờ, đau bụng, khó thở, buồn nôn hoặc nôn, chuột rút,…
Cần chú ý gì khi bệnh nhân đang trong quá trình chạy thận?
Bệnh nhân chạy thận nhân tạo cần có chế độ ăn giảm muối và các thức ăn nhiều Kali, hạn chế uống nhiều nước đặc biệt là vào những ngày không chạy thận. Bệnh nhân cũng cần chú ý chăm sóc FAV, vệ sinh sạch sẽ hàng ngày bằng xà phòng và nước ấm. Tay FAV không được xách vật nặng hoặc để bị chèn ép (như đo huyết áp,…).
Chế độ ăn protit ở bệnh nhân chạy thận nhân tạo như thế nào?
Nên bổ sung thức ăn giàu protitde vì bệnh nhân STM giai đoạn V rồi, rất suy kiệt. Chạy thận nhân tạo rồi nên vấn đề của hội chứng tăng urê máu không quá nguy hiểm nữa.
Lợi ích khi chạy thận nhân tạo là gì?
Hệ thống lọc có màng lọc nhân tạo, màng lọc này chỉ cho phép các chất cặn bã đi ra, còn các thành phần cần thiết trong máu sẽ được quay trở về cơ thể.
Chạy thận nhân tạo được thực hiện bởi nhân viên y tế, tại các bệnh viện có máy móc thiết bị phù hợp, không phải do bệnh nhân tự thực hiện. Do vậy điều kiện vô trùng vô khuẩn tốt, tránh tai biến, nếu có sự cố xảy ra trong quá trình chạy thận thì cũng có người có chuyên môn kiểm soát và xử trí.
Số lần thực hiện chạy thận trong tuần thường không quá nhiều.
Những nhược điểm khi chạy thận nhân tạo cần biết?
Bệnh nhân suy thận cần thường xuyên vào bệnh viện.
Trong quá trình chạy thận, bệnh nhân có thể bị mệt mỏi, không ổn định và huyết động, có thể bị đông máu trong các dây, ống lọc.
Dễ bị thất thoát máu, dễ bị tăng nguy cơ nhiễm trùng máu.
Bên cạnh đó bệnh nhân chạy thận nhân tạo phải thực hiện chế độ ăn kiêng khem theo chỉ định của bác sĩ.
Chạy thận nhân tạo rồi cần điều trị nội khoa không?
Vẫn điều trị nội khoa + điều trị thay thế thận.
Vì sao bệnh nhân đã chạy thận nhân tạo thì dùng thuốc lợi tiểu thường không có hiệu quả?
Bởi vì những bệnh nhân đã chạy thận nhân tạo thường đã bị vô niệu, nghĩa là cầu thận không lọc được nữa, nên không có nước tiểu ban đầu do đó sử dụng lợi tiểu không còn hiệu quả.
Chạy thận nhân tạo có phải là thay thế hoàn toàn thận được không?
Bởi vì chạy thận nhân tạo không thể trao đổi các chất trong cơ thể, mà chỉ có một vài chất. Điều này được chứng minh là khi urê máu giảm thì vẫn còn triệu chứng do các chất khác gây ra. Hơn nữa, chạy thận nhân tạo không thể thay thế được các chức năng nội tiết của thận được.
Vì sao chạy thận nhân tạo thì bệnh nhân thường tăng tỉ lệ tử vong vì tim mạch?
Bởi vì ở những bệnh nhân chạy thận nhân tạo thì nồng độ các chất và huyết áp có biên độ dao động lớn, từ đó dễ dấn đến các yếu tố tim mạch nên thường gây tăng tỉ lệ tử vong vì nguyên nhân tim mạch.
Ghép thận trong điều trị suy thận mạn
Ghép thận là phương pháp điều trị tối ưu cho bệnh nhân STM nhưng không bàn đến nhiều vì không phổ biến.
Ghép thận là phương pháp ghép một quả thận khỏe mạnh từ người hiến thận đã chết não vào cơ thể người người suy thận mạn giai đoạn cuối thay thế cho quả thận đã suy yếu, mất chức năng.
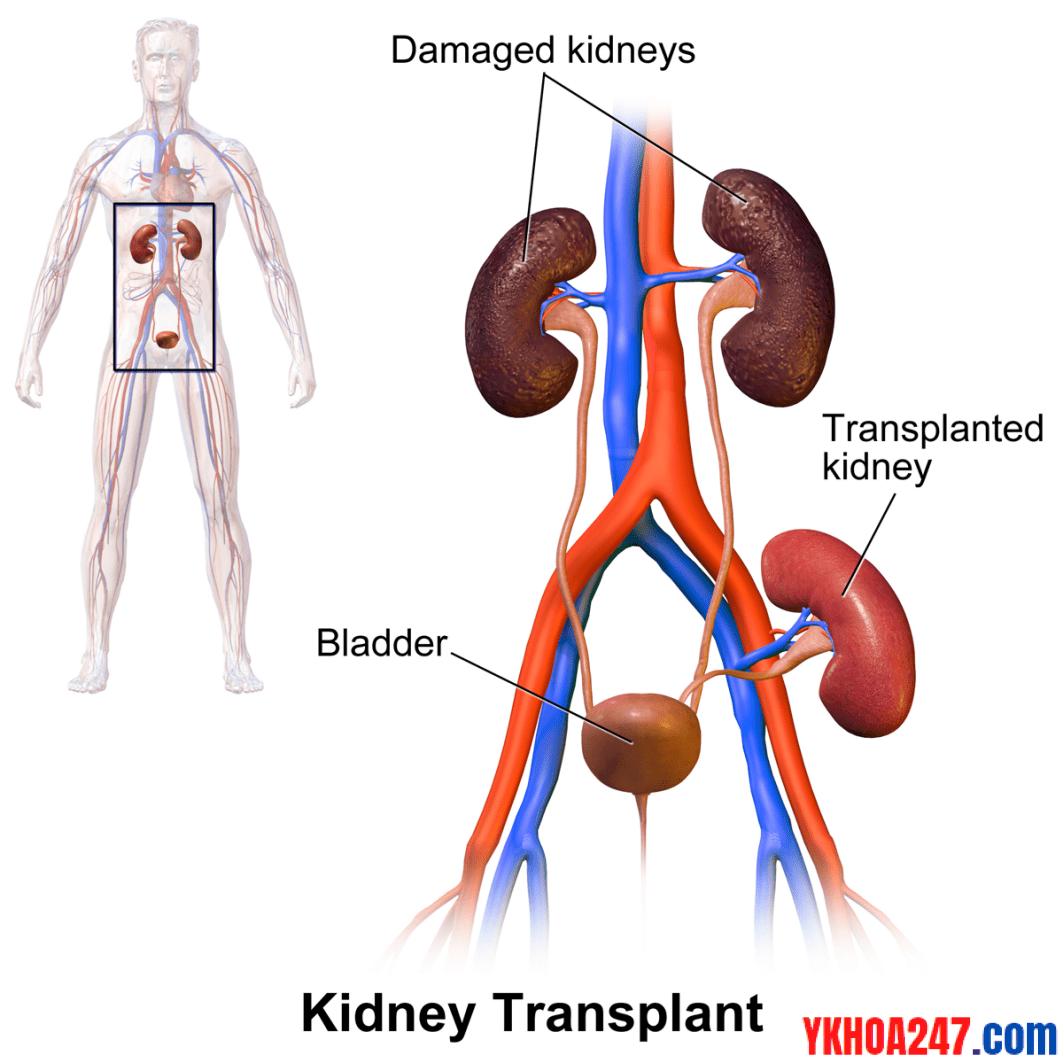
Theo bạn, ưu điểm của ghép thận là gì?
Ưu điểm của phương pháp này là sau khi được ghép thận, bệnh nhân như có được quả thận của chính mình, chất lượng cuộc sống được cải thiện, có thể sinh hoạt, ăn uống bình thường. Người bệnh có thể đi công tác, du lịch dài ngày,… mà không phải gắn với bệnh viện nhiều như các phương pháp khác.
Nhược điểm của ghép thận là gì?
Nhược điểm của phương pháp này là rất khó thực hiện. Nguồn thận được hiến tặng là rất ít, để tìm được một quả thận tương thích với cơ thể là vô cùng khó.
Mặt khác, kinh phí phẫu thuật ghép thận là khá cao.
Chi phí ghép thận ở Việt Nam nằm trong khoảng 300 – 400 triệu đồng (ngoài BHYT) và được BHYT chi trả cho hầu hết các loại thuốc đối với bệnh nhân ghép thận. Sau mổ có thể gặp những biến chứng mà phải sử dụng thuốc thêm hoặc dị ứng thuốc này phải thay bằng thuốc khác… do đó, việc chuẩn bị mức tiền trên là cả dùng cho phương án dự trù này.
Không phải bệnh nhân nào cũng có đủ sức khỏe để trải qua 1 cuộc đại phẫu ghép thận.
Nguy cơ sau khi ghép thận
Trừ khi quả thận ghép phù hợp 100% do được lấy từ anh em sinh đôi cùng trứng còn lại hầu hết các trường hợp sau khi ghép thận phải uống thuốc chống thải ghép cả đời.
Nguy cơ thải ghép sau ghép thận là điều khó tránh khỏi.
Vì sao không nên truyền máu cho bệnh nhân suy thận trước lúc ghép thận?
Bởi vì ở những bệnh nhân chuẩn bị ghép thận thì truyền máu làm tăng tỉ lệ thải mảnh ghép.
Những điểm chính trong bài học này
Bệnh thận mạn là bệnh phổ biến trong cộng đồng (chiếm 10% – 13% dân số), là mặt bệnh phổ biến trên lâm sàng.
Nguyên nhân bệnh thận mạn ở nước ta chủ yếu là do bệnh lý cầu thận (40%), ở các nước phát triển chủ yếu là đái tháo đường và tăng huyết áp.
Cơ chế bệnh suy thận mạn nhấn mạnh đến thuyết nephron nguyên vẹn.
Triệu chứng lâm sàng của bệnh nhân suy thận mạn thường là các biểu hiện của hội chứng tăng urê máu, bệnh nhân thường kèm theo tăng huyết áp và thiếu máu. Bệnh thận mạn thường không có triệu chứng cho đến giai đoạn IV và V thì các triệu chứng trong hội chứng urê cao mới biểu hiện rõ.
Cận lâm sàng trong suy thận mạn nhấn mạnh đến xét nghiệm đánh giá chức năng thận và các biến chứng.
Tiêu chuẩn chẩn đoán suy thận mạn cũng chính là định nghĩa suy thận mạn.
Phân giai đoạn suy thận mạn rất quan trọng trong tiên lượng và điều trị.
Điều trị bệnh thận mạn được chia làm 2 giai đoạn: điều trị bệnh thận mạn trước giai đoạn cuối và giai đoạn cuối. Bệnh nhân có thể gây tử vong khi tiến triển đến suy thận mạn giai đoạn cuối nếu không điều trị thay thế thận.
Nếu bệnh được phát hiện, chẩn đoán sớm và toàn diện (chẩn đoán xác định, chẩn đoán giai đoạn, biến chứng, tốc độ tiến triển, nguyên nhân) thì sẽ giúp điều trị đạt hiệu quả cao và ngăn chặn bệnh tiến đến giai đoạn cuối.
Bản quyền mọi bài viết trong khóa học kiến thức lâm sàng nội khoa thuộc về trang web YKHOA247.com.
Bản quyền thuộc © YKHOA247.com
Đây là bài viết mẫu trong hệ thống bài viết thuộc khóa học kiến thức lâm sàng nội khoa.
Bấm Đăng nhập để truy cập vào khóa học.
Bấm Đăng ký nếu chưa có tài khoản.

Sau một thời gian dài chuẩn bị, cuối cùng thì “KHÓA HỌC KIẾN THỨC LÂM SÀNG NỘI KHOA” cũng được ra mắt vào ngày 1/1/2021. Đây là sản phẩm TÂM HUYẾT của đội ngũ admin chúng tôi. Khóa học được tạo ra với mục đích chia sẻ kiến thức và kinh nghiệm nội khoa trên thực hành lâm sàng. Nội dung khóa học là các bài viết cung cấp kiến thức căn bản và chuyên sâu, được chúng tôi bàn luận, cập nhật và hoàn thiện liên tục.
